[ Deutsch ] [ English ] [ Русский ]
Herzlich willkommen!
molekulartherapie.de
Eine universelle Theorie & Therapie der Erkrankungen des zentralen Nervensystems
Kausaltheorie
1. Affektive Störungen - eine kausaltheoretische Betrachtung
1.1 Was ist eine Depression?▲
Viele Begriffe, wenig Klarheit
Informationen über Depressionserkrankungen sind überall und häufig zu finden, spätestens seitdem sie durch Aufnahme in die Gruppe der „Volkserkrankungen“ geadelt wurden. Trotz der vielen Berichte in Zeitschriften, im Internet, Radio und Fernsehen oder einer unübersichtlichen Menge von Veröffentlichungen in der Fach- und Ratgeberliteratur hat sich am grundlegenden Unverständnis gegenüber der Erkrankung nichts wesentlich geändert.
Ein Indiz dafür könnten die vielen unterschiedlichen Bezeichnungen sein, mit denen eine Depression umschrieben wird. Für die meisten Krankheiten gibt es eine eindeutige Fachbezeichnung, manchmal auch einige wenige begriffliche Differenzierungen, um beispielsweise bestimmte Formen nach Ursachen oder Symptomatik zu unterschieden. Ganz anders bei der Depression, wie die nachfolgenden Beispiele eindrucksvoll zeigen. Dabei handelt es sich nicht um eine vollständige Liste, denn immer wieder tauchen neue „Fachbegriffe“ auf. Die Bezeichnungen sind zum Teil missverständlich, nebulös, mehrdeutig, strittig oder inhaltlich ähnlich:
Agitierte Depression, Altersdepression, Anaklitische Depression, Asaisonale Depression, Atypische Depression, Bipolare Depression, Chronisch‑depressive Störung, Depression, Depression mit somatischem Syndrom, Depressive Verstimmung, Double Depression, Dysphorie, Dysthymische Depression bzw. Dysthymie, Endogene Depression, Entlastungsdepression, Erschöpfungsdepression, Exogene Depression, Gehemmte Depression, Hochfunktionale Depression, Involutionsdepression, Klinische Depression, Larvierte Depression, Lichtmangeldepression, Major Depression, Manisch‑depressive Störung, Maskierte Depression, Melancholie, Melancholische Depression, Minor Depression, Monopolare Depression, Neurotische Depression, Organische Depression, Persistierende depressive Störung, Pharmakogene Depression, Phasische Depression, Postnatale Depression, Postpartale Stimmungskrise, Prämenstruelle Depression, Primäre Depression, Psychogene Depression, Psychoreaktive Depression, Psychotische Depression, Reaktive Depression, Rezividierende Depression, Saisonal abhängige Depression (SAD), Schwangerschaftsdepression, Schwermut, Sekundäre Depression, Somatisches Syndrom, Somatisierte Depression, Somatogene Depression, Spätdepression, Subklinische Depression, Symptomatische Depression, Therapieresistete Depression, Unipolare Depression, Vegetative Depression, Versteckte Depression, Winterdepression, Wochenbettdepression, Zyklothymia, Zyklothymische Depression, Zyklothymie.
Definitionen und Diagnosen einer Depression nach ICD-10
Aber wie sieht es bei den Versuchen aus, die Erkrankung weltweit einheitlich zu kategorisieren? Gemäß der Fassung der internationalen statistischen Klassifikation ICD‑10 der Weltgesundheitsorganisation WHO aus dem Jahre 1990 werden mehrere Hauptdiagnosegruppen (F30 ‑ F34, F38 und F39) mit einigen Unterkategorien bei Affektiven Störungen unterschieden, zu denen auch die Depression zählt.
Unter Affekten wird ein Bündel von Gemütsregungen verstanden, die ein psychisch gesunder Mensch empfinden kann. Drei Symptomgruppen unterscheiden pathologisch gestörte Gefühlsregungen:
- Pathologisch gedämpfte Affekte (Depression)
- Pathologisch gesteigerte Affekte (Manie)
- Psychosen (Wahnvorstellungen oder Halluzinationen)
Die ICD-10-Klassifizierung unterscheidet sieben Kategorien affektiver Erkrankungen:
- F30 – Manische Episode
- F31 – Bipolare affektive Störung
- F32 – Depressive Episode
- F33 – Rezidivierende depressive Störung
- F34 – Anhaltende affektive Störung
- F38 – Andere affektive Störungen
- F39 – Nicht näher bezeichnete affektive Störung
ICD-10 differenziert in den Gruppen F31, F32 und F33 vier Schweregrade, ohne diese exakt zu definieren oder Anhaltspunkte zur Abgrenzung zu benennen:
- Leicht
- Mittelgradig
- Schwer ohne psychotische Symptome
- Schwer mit psychotischen Symptomen
Die Dauer einer Erkrankung berücksichtigt ICD‑10 unsystematisch. Es werden die eigenständigen Kategorien F33 für eine rezidivierende (= wiederkehrende) Depression und F34 für eine anhaltende Affektstörung verwendet, letztere wird als Dysthymie bezeichnet. Für die Dysthymie gibt es keine Differenzierung unterschiedlicher Schweregrade.
Die ICD‑10‑Klassifizierung macht keine Aussagen zu den Krankheitsursachen. Mittlerweile gibt es eine Überarbeitung, die als ICD‑11 im Jahre 2022 in Kraft trat, aber gegenüber der alten Version keine wesentlichen Änderungen aufweist.
Im Ergebnis ist die internationale Klassifizierung ein Versuch, Erkrankungen besser definieren und voneinander abgrenzen zu können, der aber wegen vieler systematischer Unzulänglichkeiten bei Affektstörungen nicht gelungen ist und immer wieder kritisiert wird. Sowohl die ICD‑10 als auch ihre Nachfolgerin ICD‑11 sind daher nicht nur wenig hilfreich, teilweise behindern sie auch, zu einem besseren Krankheitsverständnis zu gelangen.
Unipolare, bipolare, endogene und reaktive Depression
Im Schwerpunkt geht es auf diesen Webseiten um die monopolare bzw. unipolare Depression, die von der Bipolaren Depression (F31 nach ICD‑10) abzugrenzen ist. Eine Bipolare Depression wird auch manisch-depressive Erkrankung genannt. Die Bipolare Depression ist durch den Wechsel zwischen pathologisch übersteigerten Aktivitätsphasen (Manie) bzw. gedämpften Aktivitätsphasen (Depression) gekennzeichnet. Einen solchen Wechsel gibt es bei der unipolaren Depression nicht.
Eine weitere Form Affektiver Störungen ist die reaktive Depression, die sich fundamental von einer endogenen Depression unterscheidet. Bei einer reaktiven Depression sind ausschließlich äußere Umstände die Ursachen, während die endogene Form auf inneren (= endogenen) oder unklaren Faktoren beruht. Die Differenzierung zwischen endogener und reaktiver Depression ist in der Praxis eine Herausforderung.
Häufig wird eine endogene Depression auch als klinische Depression bezeichnet, um sie von der reaktiven Depression abzugrenzen. Der Begriff „klinisch“ ist allerdings nicht eindeutig, da er auf die Notwendigkeit einer (klinischen) Behandlung hinweist, die aber sowohl eine endogene als auch eine reaktive Depression betreffen kann. Dieser Begriff spielt daher in den folgenden Betrachtungen keine Rolle.
Bezeichnend ist, dass der ICD-10-Katalog die endogene Depression nicht klar von der reaktiven Depression abgrenzt. ICD-10 verortet die reaktive Depression in die Hauptkategorie F32 mit der Bezeichnung als „Depressive Episode“. Die exakte Unterscheidung zwischen endogener und reaktiver Depression ist aber zentral für das Krankheitsverständnis und spielt in den nachfolgenden Betrachtungen eine erhebliche Rolle.
Schwierigkeiten bei der Diagnose
Die Diagnose einer Depression mit Hilfe von Fragetests ist aufgrund von Auswertungsproblematiken unsicher. Ebenfalls konterkarieren die individuell‑subjektiven Bewertungen eine exakte Messung. Meist wird die Stärke der Erkrankung von der Anzahl der ausgewählten Symptome abhängig gemacht. Eine Begründung dafür gibt es nicht. Darüber hinaus existieren unterschiedliche Testverfahren. Ein besonders häufig genutzter Fragebogen ist der Depressionstest nach I. K. Goldberg, der das Likert-Skalierungsverfahren verwendet. Den Patienten werden 18 Fragen mit sechs Antwortmöglichkeiten gestellt. Der Test ist unter folgender Webadresse zu finden: https://www.netdoktor.de/selbsttests/.
Eine weitere Schwierigkeit ist die allgemein unklare sprachliche bzw. fahrlässige Verwendung des Depressionsbegriffs, die aus der Definitions- und Diagnoseproblematik und der schwierigen Objektivierbarkeit resultiert. Das Wort wird häufig benutzt, um vorübergehende negative emotionale Befindlichkeiten zu beschreiben, die aus medizinischer Sicht fern jedes Verdachts einer Erkrankung sind.
Symptome einer Depression
Im Wesentlichen ist eine Depressionserkrankung oder die depressive Phase einer bipolaren Erkrankung gekennzeichnet durch das Hauptsymptom länger anhaltender Stimmungstiefs und potentiellen Störungen in vier Bereichen: Denken, Fühlen, Verhalten und Körper:
- Denken
- Störungen der Konzentrations- und Merkfähigkeit
- Gedankenkreisen und Grübelzwang
- Denkhemmung und verlangsamtes Denken
- Übertriebener Pessimismus
- Überwiegend negative Denkinhalte
- Vermindertes Selbstvertrauen
- Psychotische Symptomatik mit Wahnvorstellungen, Halluzinationen oder Realitätsverlust
- Emotionalität, Fühlen
- Stimmungstiefs, die länger als drei Wochen andauern
- Emotionale Verflachung bzw. Erstarrung verbunden mit einem Gefühl innerer Leere
- Unbegründete und nicht korrigierbare Freudlosigkeit oder Traurigkeit
- Ständige, übertriebene Sorge und Gefühle der Hoffnungslosigkeit
- Innere Unruhe
- Angststörungen und Panikattacken
- Gestörtes Selbstwertgefühl
- Libidostörungen, sexuelle Gleichgültigkeit
- Unbegründete Schuldgefühle, bis hin zum Schuldwahn
- Verhalten
- Antriebsstörungen und Antriebsblockaden
- Agitiertheit (seltener)
- Entscheidungsschwäche
- Prokrastination
- Sozialer Rückzug
- Gehemmtes Auftreten
- Mangelnde Fähigkeit, sich abzugrenzen („nicht nein sagen können“)
- Interessenverlust
- Reizbarkeit und Aggressivität
- Suizidgedanken und Suizidversuche
- Essstörungen
- Körper (somatoforme Störungen)
- Ein- und Durchschlafstörungen, frühes Erwachen
- Hohes Schlafbedürfnis und Tagesmüdigkeit
- Allgemeine Müdigkeit
- Schnelle Erschöpfung
- Veränderter Gesichtsausdruck (zum Beispiel starre Mimik)
- Energie- und Kraftlosigkeit, Leistungseinbruch
- Kreislaufbeschwerden
- Beeinträchtigung des Seheindrucks hinsichtlich Helligkeit, Kontrast und Farbwahrnehmung
- Störungen des Verdauungssystems und Hauterkrankungen
- Appetitlosigkeit
- Appetitsteigerung
- Auffällige Gewichtsveränderungen, die nicht auf Essstörungen zurückzuführen sind
- Sexualstörungen
- Muskelverspannungen
- Schmerzen
Symptome aus dieser Liste, die nach negativen Ereignissen lediglich temporär auftreten, gelten als depressive Verstimmung und nicht als Depression. Die Symptome sind hauptsächlich schlechte Laune, Trauer oder Traurigkeit nach dem Verlust einer nahestehenden Person, begründete Frustrationsgefühle, vorübergehendes oder begründetes Grübeln, sich Sorgen machen, keine Lust auf etwas haben oder sporadische bzw. begründete Schlafstörungen. Gerade Frustrationsgefühle oder Übellaunigkeit wird im Volksmund häufig fahrlässig und fälschlicherweise als Depression bezeichnet. Nach Beseitigung der externen Auslöser verschwindet auch die depressive Verstimmung.
Allerdings kann eine depressive Verstimmung stressbedingt eine Depression begünstigen oder diese sogar maßgeblich auslösen. Der Übergang von depressiver Verstimmung zur behandlungsbedürftigen reaktiven Depression ist möglich und diese kann sich unter Umständen auch zu einer endogenen Depression weiterentwickeln. Letzteres wird in Kapitel 4 noch genauer analysiert und begründet.
Sowohl die unipolare als auch die bipolare Depression gehören ab der mittelgradigen Intensität nach ICD‑10 zusammen mit der Schizophrenie zu den schwersten psychiatrischen Erkrankungen. Kombination, Intensität und Ausprägung der Symptome sind individuell verschieden, was eine Diagnose zusätzlich erschwert.
Eine länger als drei Wochen andauernde Depression gilt als behandlungsbedürftig. Oftmals unterbleiben therapeutische Maßnahmen, da weder Erkrankte noch Außenstehende den Zustand erkennen. Schätzungen gehen von ca. vier Millionen betroffenen Menschen in Deutschland aus.
Depressionserkrankungen erhöhen die Selbstmordrate auf das 30fache. Es wird geschätzt, dass 40 bis 70 Prozent aller Suizide in Deutschland durch sie verursacht werden.
Alternative Diagnose einer Depression nach Erkrankungsintensität
Eine Klassifikation nach Stärke der Einschränkungen in der Bewältigung des Tagesablaufs ist eine sinnvolle Alternative zur Summierung von Symptomen. Die folgende Kategorisierung ist besser vergleich- und unterscheidbar, die Übergänge sind fließend.
- 1. Kategorie: Leichte Depression
Der Patient ist in seinen privaten und beruflichen Aktivitäten noch nicht oder nur leicht eingeschränkt.
- 2. Kategorie: Mittelgradige Depression
Hier werden die Alltagsaktivitäten nur unter Schwierigkeiten gemeistert, wobei die Bandbreite groß ist. Sie reicht von mittelschweren Einschränkungen bis zu Fällen, bei denen der Tagesablauf nur unter Mühe gestaltet werden kann. Bei dieser Kategorie ist deshalb eine Differenzierung in drei oder vier Unterstufen sinnvoll. Die Arbeitsfähigkeit wird zunehmend vermindert, so dass eine Reduzierung der Arbeitszeit oder ein Wechsel in eine als leichter empfundene Beschäftigungsart notwendig wird, zum Beispiel ein Wechsel vom Schichtdienst in den Tagesdienst oder von Reisetätigkeit in den Innendienst. Auch eine vollständige berufliche Veränderung kann notwendig werden.
- 3. Kategorie: Schwere Depression
Private und berufliche Tätigkeiten kommen größtenteils zum Erliegen bis zum kompletten sozialen Rückzug bzw. zur Arbeitsunfähigkeit, oft verbunden mit ausgeprägten Suizidwünschen, die aufgrund meist gleichzeitig bestehender Antriebsstörungen nicht realisiert werden. Leichte Psychosen, beispielsweise Verarmungs- oder Schuldwahn, sind möglich.
- 4. Kategorie: Schwerste Depression
Stärkste psychomotorische Störungen, oft verbunden mit Bettlägerigkeit. In Extremfällen tritt ein Stupor ein, der Patient ist nicht mehr in der Lage, sich alleine anzukleiden, Nahrung aufzunehmen oder die Körperpflege zu betreiben. Psychotische Symptome, wie Wahn oder Halluzinationen, können auftreten, meist auch stärker ausgeprägt, sind jedoch nicht zwangsläufig.
Parallel sollte eine Beschreibung einzelner Beschwerden erfolgen, zum Beispiel aus der Denken-Fühlen-Verhalten-Körper-Merkmalsliste oben, wobei die Anzahl der auftretenden Beschwerden bei der kategorischen Einordnung jedoch maximal nur eine untergeordnete Rolle spielen sollte.
Auch hier ist eine 100%ige Objektivierbarkeit, das heißt ein Rückschluss von den beschriebenen Verhaltensweisen auf die Stärke der tatsächlich individuell empfundenen Gemütseinschränkung, nicht immer möglich. Es ist häufig so, dass die Depression vom Betroffenen als wesentlich belastender erlebt wird, als es die Auswirkungen nach außen vermuten lassen. Je höher der soziale Druck ist, dem der Erkrankte ausgesetzt ist, „funktionieren“ zu müssen, desto größer kann diese Diskrepanz sein. So schleppen sich viele Betroffene beispielsweise täglich zur Arbeit und erledigen ihre sonstigen Verpflichtungen, obwohl sie aufgrund ihrer Gemütsverfassung dazu eigentlich nicht mehr in Lage sind.
Es besteht die Gefahr einer Symptomverstärkung aufgrund zusätzlicher Überbelastung, den persönlich und beruflich nahestehenden Personen wird die Schwere der Erkrankung dadurch zusätzlich verschleiert. Es besteht die Gefahr, dass das tatsächliche Ausmaß der Erkrankung vom persönlichen Umfeld nicht wahrgenommen wird.
Mulitfaktorielle Ätiopathogenese
Ein Mix genetischer, biologischer und psychosozialer Faktoren kann eine Depression auslösen ‑ diese Ursachenhypothese wird als multifaktorielle Ätiopathogenese bezeichnet. Es existiert bis heute kein Modell, das alle potentiellen Auslöser ganzheitlich integriert.
Eine biologische Erklärung als Teil der multifaktoriellen Ätiopathogenese ist die Monoaminmangelhypothese (auch: Monoaminhypothese), deren Beschreibung weiter unten folgt. Alternative Erklärungen sind die Hypothese polygenetisch-vererbter Dispositionen oder das Vulnerabilitäts-Stress-Modell.
Behandlungen mit Antidepressiva und Psychotherapie
Glaubt man Pharmakologen und Nervenärzten, ist eine Depression mit Standardmedikamenten und Psychotherapie ohne Abstriche an Lebensqualität gut behandelbar. Es wird gerne übersehen, dass die Erfolge dieser konservativen Behandlungsmethoden ernüchternd sind. Es scheint manchmal so, dass der Hinweis auf die „gute Behandelbarkeit“ einer Depression oder manisch-depressiven Erkrankung eher zur Beruhigung Betroffener geschieht und dem gut gemeinten Ziel dient, diese nicht zu verunsichern und für eine medikamentöse Behandlung zu gewinnen.
Besonders kontraproduktiv sind die vielen Medienbeiträge, die Betroffenen Mut machen sollen und das Gegenteil erreichen. Dort erhalten sie „Tipps“ wie „verbessern Sie Ihre Stimmung durch positive Aktivitäten, treiben Sie Sport, denken Sie positiv, gehen Sie Ihren Hobbys nach, steigern Sie Ihre Wertschätzung“ etc. Jeder, der eine Depression oder bipolare Erkrankung aus eigener Erfahrung kennt, spürt die Ratlosigkeit hinter derartig floskelhaften, gut gemeinten Ratschlägen. Diese sind darüber hinaus geeignet, die Erkrankung zu verharmlosen, erwecken den falschen Eindruck einfacher Behandlungsstrategien und unterstellen eigene Verfehlungen und damit eine Mit- oder sogar Hauptschuld an der Erkrankung.
All dies widerspricht der allgemein ungünstigen Krankheitsverlaufsprognose, die in zahlreichen Veröffentlichungen bzw. Studien dokumentiert ist (→ Härter/Bermejo/Niebling, Praxismanual Depression, Deutscher Ärzte-Verlag, Köln 2007, www.lbib.de/...).
Zusammenfassend lassen die Untersuchungen folgende Schlüsse zu:
- Bei etwa 1/3 der medikamentös oder psychotherapeutisch Behandelten verschwindet die Depression. In der Regel sind die Gründe der Gesundung nicht auf bestimmte (Einzel-)Maßnahmen zurückzuführen.
- Etwa 1/3 der mit Antidepressiva und/oder psychologisch Behandelten bekommen ihre Situation nur unzulänglich in den Griff – mit Nebenwirkungen bzw. deutlichen Abstrichen an Lebensqualität. Schon hier kann von einer Heilung im eigentlichen Sinne nicht mehr die Rede sein.
- Beim letzten Drittel wirken die Medikamente nicht und verschlechtern die Situation in manchen Fällen noch durch ihre massiven Nebenwirkungen. Das gilt insbesondere für Patienten mit schwerer oder schwerster Depression. Ihnen bleiben noch die restlichen Behandlungsmethoden, beispielsweise Elektrokrampftherapie, Schlafentzug oder die Magnetfeldtherapie, die in der Regel aber zu keinem langfristigen Erfolg führen.
In der Medizin wird das als Drittel-Regel bezeichnet, und eine ähnliche Verteilung ist auch bei Behandlungen anderer psychiatrisch-neurologischer Erkrankungen feststellbar.
Der ungünstige Erkrankungsverlauf resultiert vor allem aus der unzulänglichen Wirksamkeit von Antidepressiva. So wurde im Rahmen von Initiativen zur Verbesserung der Qualität pharmazeutischer Produkte festgestellt, dass selektive Serotonin-Wiederaufnahmehemmer (SSRI)* bei 38% der Behandlungen keinerlei Wirkungen zeigen, wobei über den Behandlungserfolg der restlichen 62 % keine Informationen vorliegen. Ähnliche Bewertungen liegen auch bei anderen neurologischen Erkrankungen vor. Bei Medikamenten gegen Morbus Alzheimer lag die Quote der Unwirksamkeit sogar bei 70% (Quelle: Spear/Heath-Chiozzi/Huff, Clinical application of pharmacogenetics, in: Trends in Molecular Medicine, Vol. 7/No. 5, Mai 2001).
Die Ergebnisse einer Metastudie über die Wirkung von SSRI und SSNRI* aus dem Jahre 2008, die nach ihrer Veröffentlichung eine breite mediale Aufmerksamkeit bekamen und auf der Auswertung von etwa 50 Einzelstudien beruhten, waren noch niederschmetternder: Sie ergaben klare Beweise, dass die Medikamente nicht wirksamer sind als die Scheinpräparate (Quelle: Kirsch et al. 2008, Public Library of Science Medicine, Bd. 5). Nur bei schweren Erkrankungsfällen wurde ein kleiner und unbedeutender Unterschied zum Placebo festgestellt. Allerdings betraf die Untersuchung ausschließlich Studien über die Wirkstoffe Fluoxetin, Venlafaxin, Nefazodone und Paroxetin, so dass die Aussagen nicht auf alle Medikamente dieser Wirkmechanismen übertragen werden können. Die Resultate sind jedoch typisch und bestätigen die erwähnten Vorbehalte. Mit interessanten Details zu Paroxetin beschäftigt sich auch der folgende Abschnitt.
Die Studienergebnisse von Kirsch et al. wurden nach ihrer Publikation von Pharmaherstellern und Fachärzten kritisiert. Prof. Dr. Ulrich Hegerl vom Universitätsklinikum Leipzig entgegnete, dass „(...) die Schlussfolgerung dieser Übersichtsstudie aber auf mehreren Fehlern beruht. Klinische Studien wie die, die Kirsch und sein Team von der University of Hull überprüft haben, sollten die prinzipielle Wirksamkeit der Antidepressiva überprüfen. In solchen Untersuchungen werden die Patienten umsorgt, aktiviert, sie erhalten Zuspruch, es wird ihnen Hoffnung vermittelt. Dabei kommt es zu einem riesigen Placebo-Effekt. Deshalb ist der Unterschied zwischen der Wirkung der Scheinmedikamente, die da verabreicht werden, und den echten Mitteln, so gering, wie Kirsch jetzt kritisiert. Denn diese Versorgung hilft zwar auch den Patienten, die das echte Medikament erhalten, die Wirkung der Maßnahmen addiert sich aber nicht.“ (Quelle: Markus C. Schulte von Drach im Interview mit Ulrich Hegerl am 17.5.2010, Studie zu Antidepressiva - „Diese Berichte werden Menschenleben kosten“, SZ.de, Süddeutscher Verlag, München 2010, http://www.sueddeutsche.de/wissen/...).
Sind die Einwände von Prof. Hegerl berechtigt? Zunächst ist es nicht möglich, die ca. 50 Einzelstudien bezüglich der Aussagen von Ulrich Hegerl zu prüfen, beispielsweise bezüglich der „Umsorgung“ der Teilnehmer. Mindestens genauso wahrscheinlich ist ein unpersönlicher, wenig umsorgender Studienablauf. Und selbst wenn es so wäre, wie Ulrich Hegerl behauptet: Ist eine medizinische Behandlung außerhalb von Studien denn in der Regel nicht ebenso „umsorgend“? Bei genauer Betrachtung macht gerade sein Einwand deutlich, dass die Medikamente und die Scheinmedikamente sich von ihrer Pharmakodynamik nicht oder kaum unterscheiden. Denn es müsste doch wenigstens ein ausreichend signifikanter Unterschied zwischen Placebo und einem Medikament feststellbar sein, auch wenn unterstellte Wirkungen durch Aktivierung und Umsorgung und die durch den echten Wirkstoff sich niemals „mathematisch“ verdoppeln und das auch niemand fordert.
Es ist natürlich viel von überzeugten SSRI‑ und SSNRI‑Therapeuten verlangt, sich kritisch über die Wirksamkeit dieser Antidepressiva zu äußern. Denn das bedeutet, die eigene auf diesen Präparaten beruhende Behandlungsstrategie zumindest teilweise in Frage stellen zu müssen. Unverständlich bleiben jedoch unpräzise und hilflose Argumentationen wie die oben zitierten von Ulrich Hegerl. Es lässt darauf schließen, dass den Studienaussagen nichts Substanzielles entgegenzusetzen ist.
Solche Äußerungen sind leider keine Einzelfälle und einige könnte man auch als bewusst gezündete „rhetorische Nebelkerzen“ deuten. Das Problem liegt jedoch auch im beschränkten Angebot medikamentöser Behandlungen gegen Affektstörungen, die fast ausschließlich auf der Manipulation von Monoaminen beruhen. Denn was sollten Psychiater auch sagen, wenn sie kaum eine andere Möglichkeit haben, ihre Patienten medikamentös zu behandeln?
Das leitet über zu den Herstellern, die sich ebenfalls am Monoaminmangel-Mythos abarbeiten. Die Herstellerfinanzierung der meisten Antidepressivastudien ist problematisch. In verschiedenen Beiträgen wird berichtet, dass Pharmaunternehmen ihre eigenen Medikamente durchweg besser beurteilen als Vergleichspräparate und darüber hinaus massiv Studien unveröffentlicht lassen, die keinen Wirksamkeitsnachweis ihrer Wirkstoffe erbringen (Quellen: Hansen RA et al., Internal Med, 9/2005; Whittington CJ et al., Lancet 2004, Artikel im New England Journal of Medicine vom 17.1.2008). Eine Übersicht über den Themenkomplex enthält folgende Web-Seite: www.adfd.org/Manipulation bei Antidepressiva-Studien.
Die Studie 329 des Paroxetin-Herstellers GlaxoSmithKline
Ein gutes Beispiel, dass bei nicht herstellerunabhängig erstellten Studien Misstrauen berechtigt ist, betrifft eine zwischen den Jahren 1994 und 1998 durchgeführte Studie über die Wirksamkeit und Verträglichkeit des SSRI-Wirkstoffes Paroxetin an Heranwachsenden mit einer unipolaren Depression (Quelle: Paroxetin bei Jugendlichen unwirksam, Pharmazeutische Zeitung online, 17.9.2015, Govi-Verlag Pharmazeutischer Verlag GmbH, Eschborn 2015, http://www.pharmazeutische‑zeitung.de/...).
Im Juli 2001 veröffentlichte ein 21-köpfiges Team um den Psychiater Martin Keller von der Brown University School of Psychiatry and Human Behavior, Providence/USA, die besagte Untersuchung über Produkte des damaligen Pharmaherstellers SmithKline Beecham (heute: GlaxoSmithKline) in der rennomierten Fachzeitschrift Journal of the American Academy of Child and Adolescent Psychiatry (M. Keller et al., Efficacy of Paroxetine in the Treatment of Adolescent Major Depression: A Randomized, Controlled Trial, http://www.jaacap.com/...).
Die Zusammenfassung der damaligen Studienergebnisse belegte eine gute Wirksamkeit und Verträglichkeit der Paroxetin-Präparate von SmithKline Beecham ‑ Handelsnamen Paxil bzw. Seroxat ‑ bei Kindern und Jugendlichen (Originalzitat aus dem Abstract: „Paroxetine is generally well tolerated and effective for major depression in adolescents.“).
Diese positiven Schlussfolgerungen der Autoren wurden jedoch von Beginn an in Zweifel gezogen, da sie der ausführlichen Studiendokumentation völlig widersprachen. Die Studie wurde erstmals im Jahre 2002 von einem Mitarbeiter der amerikanischen Aufsichtsbehörde für Arzneimittel U. S. Food and Drug Association (FDA) bis ins Detail überprüft. Dieser stellte fest, dass Paroxetin gegenüber dem Placebo keine signifikante Überlegenheit zeigte. Das gilt auch für das in der Studie zum Vergleich herangezogene trizyklische Antidepressivum Imipramin. Die jeweils achtwöchigen Verabreichungen bewirkten auf der 66 Punkte umfassenden Hamilton-Skala eine Verbesserung um 10,7 Punkte (Paroxetin), 9,0 Punkte (Imipramin) beziehungsweise 9,1 Punkte (Placebo). Die Abweichungen zum Placebo waren somit minimal und weit jenseits eines Wertes, der als brauchbar anzusehen ist. Signifikant hingegen waren die Nebenwirkungen: Paroxetin erhöhte beispielsweise die Suizid-Gefahr erheblich, Imipramin ging mit einem erhöhten kardiovasuklären Risiko einher.
All das hat den Markt für Paroxetin bei Jugendlichen zunächst nicht tangiert. Alleine in den USA wurde 2002, also im Jahr der ersten Überprüfung durch die US-amerikanische FDA, über zwei Millionen mal Paroxetin für Kinder und Jugendliche verordnet.
Erst aufgrund Nachforschungen britischer Journalisten und ihrer Veröffentlichungen in verschiedenen BBC‑Reportagen wurden die britische Zulassungs- und Aufsichtsbehörde für Arzneimittel Medicines and Healtcare Products Regulatory Agency und auch ihr US-amerikanisches Pendant FDA ‑ die FDA nun schon zum zweiten Mal nach 2002 ‑ auf den Fall aufmerksam. Im Juni 2003 informierten beide Behörden Fachkreise und Ärzte und wiesen diese an, Paroxetin nicht mehr an Jugendliche unter 18 Jahren zu verschreiben.
Die Verfehlungen im Zusammenhang mit dieser Studie waren sehr komplex und gingen über manipulative Formulierungen im Studien-Abstract weit hinaus. Es wurden nicht nur Ergebnisse manipuliert und zurückgehalten. Die Namen einiger Studienteilnehmer hatte man sich ausgedacht und mindestens drei Jugendliche wurden nach Suizidversuchen mit der Begründung aus der laufenden (!) Studie ausgeschlossen, sie seien ungeeignet für eine Teilnahme.
Auch die Vermutung eines Herausgebers des British Medical Journals, dass die Textentwürfe der Studiendokumentation von Ghostwritern des Herstellers geschrieben wurden, hat sich bestätigt. GlaxoSmithKline beauftragte die auf Pharmaprodukte spezialisierte PR-Agentur Scientific Therapeutics Information mit der Erstellung des Fachartikels, der später unter dem Namen von Martin Keller veröffentlicht wurde. (Quelle: Controversial Paxil paper still under fire 13 years later, 2.4.2014, The Brown Daily Herald, Providence, Rhode Island/USA, 2014, http://www.browndailyherald.com/...).
Das passt zu dem Fakt, dass die 21 angegebenen „Mitautoren/-innen“, allesamt die Crème de la Crème der amerikanischen Kinderpsychiatrie, überhaupt nicht direkt an der Durchführung der Untersuchung beteiligt waren.
Darüber hinaus arbeiteten damals der „Studienleiter“ Martin Keller und mindestens einer der „Mitautoren“, hier: James P. McCafferty, für SmithKline Beecham. Einen Hinweis auf Interessenkonflikte sucht man im Studiendokument jedoch vergeblich.
Es stellte sich heraus, dass SmithKline Beecham bzw. GlaxoSmithKline Studien im Zusammenhang mit Paroxetin-Präparaten schon immer manipulierte und diesen niemals eine Wirksamkeit hätte attestiert werden dürfen, die über die Placebowirkung hinausreicht.
Die Verfehlungen des Herstellers führten zum größten Strafverfahren in der Geschichte der Pharmazie. Im Jahre 2012 akzeptierte GlaxoSmithKline eine Strafe in Höhe von 3 Milliarden US‑Dollar wegen verschiedener Manipulationen, hauptsächlich jedoch im Zusammenhang mit der Studie 329.
Dennoch hält die Diskussion um den Wirkstoff und die Veröffentlichung an. Trotz mehrfacher Aufforderung in den Jahren 2003, 2005 und 2009, die Studie nachträglich zurückzuziehen, weigern sich die Herausgeber des Journal of the American Academy of Child and Adolescent Psychiatry bis heute. Im Jahre 2013 wurde dieses Anliegen erfolglos dem Hersteller GlaxoSmithKline vorgetragen.
Dass die Studie 2015 nochmals begutachtet und der Skandal damit weiter ein Thema bleibt, ist der Initiative der Forschergruppe Restoring Invisible and Abandoned Trials/RIAT und dem British Medical Journal zu verdanken.
Bis heute (Stand März 2023) sind Paroxetin-Präparate auf dem Markt und werden gegen verschiedene psychiatrische Erkrankungen verschrieben.
Die monoaminen Botenstoffe und die Monoaminmangelhypothese
Die medizinische Forschung konzentriert sich bis heute vor allem auf die monoaminen Neurotransmitter Noradrenalin und Serotonin*, denn beide sollen mit einer Depression in einem engen Zusammenhang stehen. Die meisten der sich auf dem Markt befindlichen Medikamente manipulieren daher die Reizübertragung dieser beiden Substanzen im Gehirn. Die Frage nach den genauen Kausalitäten zwischen Störungen im Noradrenalin- und Serotoninstoffwechsel und einer Affekterkrankung bleibt unbeantwortet. Es gibt hier leider keine einheitliche Meinung.
Diese sogenannte Monoaminmangelhypothese wird von vielen Forschern bezweifelt (Quelle u. a.: Köhler 2005), da die lange Verzögerungszeit der Wirkung eher für andere Ursachen spricht. Die Medikamente wirken nach der Einnahme an den Übertragungsstellen der Nervenzellen sofort, während die eigentliche depressionsmindernde Wirkung ‑ sofern überhaupt eine eintritt, siehe oben ‑ in den meisten Fällen erst nach mehreren Wochen einsetzt. Viele Wissenschaftler gehen daher davon aus, dass eher nachgelagerte Prozesse für die Minderung der Symptome verantwortlich sind.
Darüber hinaus werden die langen Wirkungsverzögerungszeiten vieler Substanzen auch mit Placebo-Effekten in Zusammenhang gebracht.
Viele Mediziner sehen ein weiteres Problem im breiten Wirkungsspektrum der Antidepressiva und schließen eher auf eine beruhigende, angstlösende Wirkung der Mittel anstatt einer Senkung der depressiven Symptomatik (Quelle: Moncrieff/Kirsch 2005).
Wegen der Skepsis bezüglich Serotonin und Noradrenalin wird derzeit verstärkt nach Möglichkeiten geforscht, andere monoamine Neurotransmitter zu beeinflussen. So soll der relativ neue Wirkstoff Bupropion (Handelsname Elontril) Dopamin* manipulieren. Andere Forschungsaktivitäten beschäftigen sich mit der Manipulation des Neurotransmitters Gamma-Aminobuttersäure (GABA)*.
* Anmerkung: Weitere Erläuterungen zu den verschiedenen Neurotransmitterformen und über das Wirkungsprinzip von Antidepressiva im folgenden Abschnitt 1.2.
1.2 Ursachen einer Depression auf Zellebene (Mikrosicht) ▲
Nach der Monoaminmangelhypothese werden Botenstoffmängel oder Botenstoffübertragungsstörungen an den Kontaktstellen zwischen den Nervenzellen vermutet. Das betrifft vor allem die beiden Neurotransmitter Serotonin und Noradrenalin, denen stimmungsaufhellende bzw. antriebsfördernde Wirkungen unterstellt werden.
Eindeutige Aussagen und schlüssige Erklärungen über Ursache-Wirkungs-Beziehungen gibt es nicht. Es wird nichts darüber ausgesagt, ob der angebliche Serotonin- oder Noradrenalinmangel eine Depression verursacht, ob der Zusammenhang umgekehrt ist oder ein anderer Zusammenhang besteht. Niedrige Serotoninwerte von bis zu ‑50% sind bei vielen Depressiven in verschiedenen Körperflüssigkeiten (Blutserum, Urin, Speichel oder Liquor) messbar, jedoch gibt es auch Untersuchungen, die zu gegenteiligen Ergebnissen kommen. Die Höhe des Serotoninspiegels ist nur bedingt aussagekräftig, denn die Werte in verschiedenen Körperflüssigkeiten sagen nichts aus über die unmittelbaren Vorgänge an den Kontaktstellen der Nervenzellen im Gehirn.
So gehen die Meinungen über die Serotoninwirkungen weit auseinander. Ein Artikel des Magazins Zeit Wissen aus dem Jahre 2008 fasst die Kontroverse sehr anschaulich in wenigen Sätzen zusammen: „Der Botenstoff Serotonin hat eine erstaunliche Karriere als Glückshormon hingelegt. Maßgeblich beteiligt daran waren Werbemaßnahmen für Medikamente. Seit 1965 verdächtigen Ärzte einen niedrigen Serotonin-Spiegel im Gehirn, für Depressionen verantwortlich zu sein. Doch die große Zeit des Botenstoffs begann in den 80er Jahren. Damals wurde eine neue Art von Antidepressiva entwickelt, die Selektiven Serotonin-Wiederaufnahme-Hemmer (SSRI, berühmt wurde vor allem Prozac, in Deutschland unter dem Namen Fluctin im Handel). Diese sollen verhindern, dass die Nervenzellen im Gehirn das ausgeschüttete Serotonin zu schnell wieder aufnehmen. Auf der deutschen Internetseite des Pharmaherstellers Pfizer steht nach wie vor: «Bei einer Depression besteht ein Mangel an Serotonin.» Doch dies konnte bis heute keine Studie nachweisen. Manche Depressive haben sogar einen höheren Serotonin-Spiegel als Gesunde. Was ein normaler Wert ist, weiß ohnehin niemand. Außerdem dauert es in der Regel mehrere Wochen, bis die SSRI bei Patienten Wirkung zeigen, obwohl die Wiederaufnahme-Hemmung schon nach den ersten Tabletten einsetzt. Viele Forscher vermuten inzwischen, dass Serotonin nur indirekt mit der Depression zu tun hat. Die irische Medikamenten-Aufsichtsbehörde jedenfalls untersagte 2003 einem Pharmahersteller, in Informationsbroschüren zu behaupten, das Antidepressivum korrigiere ein chemisches Ungleichgeweicht im Gehirn.“ (Quelle: Eva‑Maria Schnurr, Gefährliche Helfer, Zeit Wissen 2/2008, Zeitverlag Gerd Bucerius, Hamburg).
Kenntnisse von an affektiven Vorgängen beteiligten Neurotransmittern und deren genaue Wirkungen sind sehr rudimentär - und das betrifft nicht nur Serotonin oder Noradrenalin. Es wird mittlerweile von etwa 1.000 Substanzen ausgegangen, die bei der Übertragung von Nervenreizen alleine für Gefühlsregungen eine Bedeutung haben (Quelle: C. Eberhard‑Metzger, Glück ist, wenn die Chemie stimmt, in: Bild der Wissenschaft, Konradin Medien GmbH, Leinfelden-Echterdingen 1999, www.wissenschaft.de/.../65655/).
So wurden weitere Neurotransmitter identifiziert, die hier eine Rolle spielen könnten, beispielsweise Dopamin, Acetylcholin, Aspartam, Dimethyltryptamin, Histamin oder die Gamma-Aminobuttersäure (GABA).
Auch eine Vielzahl von Endorphinen bzw. Neuropeptiden ist in die Nervenreizübertragung und -weiterleitung involviert. Die Existenz unbekannter Botenstoffe ist ebenso wahrscheinlich. Weiter gibt es zahlreiche Neuromodulatoren wie Spurenamine, die Gefühle und Empfindungen im Nervensystem steuern und in ihrer Wirkung noch wenig erforscht sind. Viele Nervenzellen schütten Kotransmitter aus, die ebenfalls zur Gruppe der Neuromodulatoren gehören und im Bereich der Emotionen stark steuernd eingreifen. Deren Wirkungsmechanismen sind noch so gut wie unbekannt.
Andere wichtige Substanzen sind Neutrophine oder Nervenwachstumsfaktoren, die als Neurostimulatoren für die Entwicklung und Funktionsfähigkeit von Nervenzellen eine große Bedeutung haben. Der wichtige Nervenwachstumsfaktor BDNF (Brain-derived neurotropic factor) wird aktuell verstärkt erforscht. Ein BDNF-Mangel wird mit verschiedenen Nervenerkrankungen in Verbindung gebracht, unter anderem auch mit Affektstörungen.
Die zahlreichen Symptome einer Depression verweisen ebenfalls auf einen komplexen Ursachenmix: Eine auf Ungleichgewichte weniger Botenstoffe basierende Erklärung der Erkrankung ignoriert eine Symptomvielfalt, die nicht ausschließlich durch Stimmungstiefs oder Antriebsarmut gekennzeichnet ist.
Mit den gängigen Medikamenten ist man derzeit lediglich in der Lage, die Übertragung monoaminer Neurotransmitter zu manipulieren, wobei noch nicht einmal die genauen Wirkmechanismen der Präparate verstanden werden: Durch Tricks wird erreicht, dass die Botenstoffe länger im synaptischen Spalt zwischen den Nervenzellen verbleiben. Auch auf die Reizweiterleitung innerhalb der Nervenzellen in deren faserartigen Axonen haben die Medikamente keinen direkten Einfluss.
Eine direkte Erhöhung der Botenstoffe in der Zelle ist pharmakologisch nicht möglich und würde darüber hinaus mit hoher Wahrscheinlichkeit unerwünschte Gegenreaktionen der Nervenzellen auslösen. Eine industrielle Produktion von Serotonin gilt als ausgeschlossen, und ein solches (fiktives) Präparat würde nicht in der Lage sein, die Blut-Hirn-Schranke zu überwinden. Ebenfalls ist zu erwarten, dass längerfristig eingenommenes Serotonin ‑ mal hypothetisch unterstellt, es erreiche die Nervenzellen im Gehirn gezielt ‑ eine Gegenreaktion serotonerger Neuronen zur Folge hätte, indem diese ihre Eigenproduktion noch weiter drosseln. Ein weiteres Szenario ist die Reduktion der Anzahl von Serotoninrezeptoren aufgrund einer externen Serotoninzufuhr.
Die zentrale Frage lautet: Ist die Monoaminmangelhypothese plausibel und sind die Wirkungsmechanismen derzeit verfügbarer Antidepressiva geeignet, eine Depression erfolgreich zu therapieren? Zur Beantwortung müssen die Wirkungsmechanismen der Medikamente und die Konsequenzen ihrer Anwendung umfassend bewertet werden, woraus 14 Einwände resultieren:
- Antidepressiva bewirken lediglich die Erhöhung von Botenstoffen im synaptischen Spalt.
- Die Mehrzahl der Medikamente zielen nur auf wenige Botenstoffarten, obwohl es wesentlich mehr gibt, beispielsweise weitere monoamine Neurotransmitter oder Neuropeptide.
- Es gibt keinen Nachweis, dass eine verminderte Konzentration bestimmter Botenstoffe im synaptischen Spalt die Ursache einer Depression ist.
- Sämtliche anderen Mechanismen des komplexen Reizübertragungsprozesses werden durch die Medikamente nicht gezielt verändert.
- Eine substanzielle Erhöhung der Botenstoffe in den Nervenzellen bzw. Synapsen findet nicht statt.
- Neben monoaminen Botenstoffen und Neuropeptiden gibt es noch Neuromodulatoren, die an der Reizübertragung zwischen Nervenzellen beteiligt sind, beispielsweise Spurenamine oder Kotransmitter.
- Die Manipulation der Botenstoffkonzentrationen birgt die Gefahr des Auslösens von Nebenwirkungen aufgrund unkalkulierbarer Gegenreaktionen betroffener Nervenzellen.
- Die selektive Botenstoffmanipulation während der Reizübertragung wirkt sich ggf. negativ auf die restlichen Botenstoffe der Zelle und den Reizübertragungsprozess im Allgemeinen aus, wodurch sich ebenfalls zahlreiche Nebenwirkungen erklären lassen.
- Die Manipulation von Botenstoffen wirkt sich ggf. negativ auf andere Funktionen der Zelle aus, und dies hat möglicherweise weitere unkalkulierbare Nebenwirkungen zur Folge.
- Die Medikamente entfalten ihre Wirkung ungesteuert im gesamten Gehirn und wirken sich mit hoher Wahrscheinlichkeit auf nicht betroffene Nervenzellen und deren Neurotransmitterstoffwechsel als auch auf andere Zellvorgänge ungünstig aus. Das birgt die Gefahr weiterer Nebenwirkungen.
- Den Reizweiterleitungsprozess in den Nervenfasern können die Medikamente nicht beeinflussen.
- Die Einnahme von Psychopharmaka ist ein statischer Prozess und erfolgt meist einmal täglich oder deren Aufnahme wird mit Hilfe von Wirkstoffverzögerungsmechanismen über einen längeren Zeitraum verteilt (Retard-Wirkung). Das Geschehen in den Nervenzellen ist demgegenüber ein hochkomplexer, dynamischer Prozess, der durch ständige, oftmals sekundenschnelle Anpassungen charakterisiert ist.
- Die Symptomvielfalt einer Depression lässt auf eine entsprechende Ursachenvielfalt auf der Zell- und Organebene schließen. So beeinflusst Serotonin gegebenenfalls die Stimmungslage positiv, jedoch mit hoher Wahrscheinlichkeit nicht als einzige Substanz. Und wie sollen mit der alleinigen Manipulation des Serotonins Antriebsblockaden, emotionale Erstarrung und Schwierigkeiten mit Konzentration und Gedächtnis und die anderen zahlreichen Symptome beseitigt werden?
- Weitere potentielle zellbiologische oder hirnorganische Ursachen einer Depression bleiben unberücksichtigt.
Das Ergebnis aus diesen 14 Einwänden: Bedingt durch ihren unvollständigen und manipulativen Ansatz sind die gängigen Antidepressiva nicht im Mindesten in der Lage, den Anforderungen an eine ursächliche Therapie gerecht zu werden. Die hohe Unzufriedenheit bei vielen Erkrankten und deren Angehörigen und die von fachlicher Seite geübte Kritik decken sich mit der oben erwähnten Tatsache, dass mindestens 2/3 der Behandelten nicht oder nur bedingt von ihnen profitieren.
Erste Schlussfolgerungen ergeben sich vor allem aus den Einwänden 1 bis 6, 11, 12 und 14, die eine wesentlich komplexere neuronale Funktionsstörung nahelegen und zur ersten These führen:
- Depressionserkrankungen beruhen auf komplexen Störungen neuronaler Funktionen.
Eine fehlerhafte Reizübertragung aufgrund von Problemen mit einzelnen monoaminen Botenstoffen ist nur eine mögliche Ursache der Erkrankung. Ebenso sind andere Fehler bei der Reizentstehung, Reizübertragung als auch der Reizweiterleitung in Betracht zu ziehen. Darüber hinaus kommen auch Störungen neuronaler Aktivitäten in Frage, die einen gänzlich anderen Charakter´haben.
Gliazellen: Mehr als nur Statisten im Zentralnervensystem
Die Gliazellen wurden bis vor wenigen Jahren noch kaum beachtet, obwohl ihre Anzahl im menschlichen Gehirn auf bis zu 100 Billionen geschätzt wird und das Gehirn eines Menschen in manchen Arealen bis zu 50-mal mehr Gliazellen als Neuronen haben kann. Bei einer Untersuchung des Gehirns von Albert Einstein fand die Forscherin Marian Diamond in den 1970er Jahren heraus, dass dessen assoziativer Cortex, ein wichtiges Areal des vorderen Großhirns, bedeutend mehr Gliazellen enthielt als der eines durchschnittlich begabten Menschen (Quelle: Bild der Wissenschaft, Konradin Medien GmbH, Leinfelden-Echterdingen 9/2008). Der Begriff Hirnzellen schließt daher, neben den verschiedenen Neuronenarten, die Gliazellen ein.
Zunächst wurde den Gliazellen nach ihrer Entdeckung im 19. Jahrhundert durch Rudolf Virchow nur eine Funktion als „Nervenkitt“ zur Stützung der Neuronen zugeschrieben.
Nach und nach hat sich das Wissen über ihre Funktionen erhöht und seit einigen Jahren ist bekannt, dass eine bestimmte Sorte von Gliazellen, die Astrozyten, sogar den Informationsaustausch an den Synapsen der Neuronen modulieren, indem sie eigenständig Neurotransmitter ausschütten. Weiter sind Astrozyten für den An‑ und Abtransport von Flüssigkeit zuständig und nehmen überschüssige Kalium‑Ionen während der Reizweiterleitung auf. Bestimmte Typen von Astrozyten sind in der Lage, Neurogenese zu betreiben, das heißt sich in Neuronen umzuwandeln, um Lücken aufzufüllen. Neueste Forschungen weisen darauf hin, dass Astrozyten auch aktiv den Glukosetransport ins Gehirn steuern (Quelle: Pharmazeutische Zeitung online, Gliazellen regulieren aktiven Zuckertransport ins Gehirn, Avoxa - Mediengruppe Deutscher Apotheker GmbH, 12.8.2016, http://www.pharmazeutische-zeitung.de/...).
Darüber hinaus stellen die Mikrogliazellen das Immunsystem des Gehirns dar und sind für den Abtransport schädlicher Stoffe, beispielsweise Teilen abgestorbener Zellen, zuständig.
Andere Typen von Gliazellen bilden die weiße Myelinschicht, welche die Axone der Neuronen voneinander isoliert und für die Nervenreizweiterleitung wichtig ist. Diese Gliazellen werden im Gegensatz zur „grauen Substanz“, den eigentlichen Nervenzellkörpern, als „weiße Substanz“ bezeichnet. Im Rückenmark und Gehirn sind das die Oligodendrozyten und außerhalb davon im peripheren Nervensystem die Schwann'schen Gliazellen.
Forscher der Universität Stanford/Kalifornien (Quelle: Barres et al. 2005) haben nachgewiesen, dass Gliazellen für die Anzahl der von Nervenzellen gebildeten synaptischen Verbindungen verantwortlich sind und an regenerativen Vorgängen im Gehirn mitwirken.
Die oben beschriebenen Funktionen sind aber nur ein kleiner Teil dessen, was Gliazellen im Nervensystem leisten. Quintessenz: Die Qualität der Informationsverarbeitung und der Gesundheitszustand eines Gehirns hängen wesentlich von den Gliazellen ab. Daher nun eine zweite These:
- Dysfunktionale Gliazellen sind weitere potentielle Störer neuronaler Aktivitäten und damit eine potentielle Ursache einer Depressionserkrankung.
Neben den Nervenzellen haben Gliazellen, welche unter anderem für die neuronale Ver- und Entsorgung und die Isolation der Nervenzellfasern zuständig sind und sich auch aktiv an der neuronalen Kommunikation und Neurogenese beteiligen, einen erheblichen Anteil an der Gehirnfunktionalität. In ihrer Funktionsfähigkeit gestörte Gliazellen sind möglicherweise sowohl ausschließlich als auch zusätzlich für eine Erkrankung verantwortlich. Gliazellen sind jedoch durch Antidepressiva nicht beeinflussbar.
These 2 ist eine Konsequenz der Einwände 1, 3, 4 und 14 aus der Aufzählung oben.
1.3 Ursachen einer Depression auf Ebene der Hirnareale (Makrosicht) ▲
Für ein umfassendes Verständnis einer Nervenerkrankung sind Überlegungen unzureichend, die sich ausschließlich an Funktionsweise und Funktionsfähigkeit einzelner Zellen orientieren. Es ist unwahrscheinlich, dass bei einer Depression sämtliche Neuronen bzw. Gliazellen des Gehirns erkrankt sind. Und es trifft wohl nur auf eine geringe Anzahl neurologischer Erkrankungen zu, bei denen Hirnzellen in unterschiedlichen Hirnregionen betroffen sind, die funktional ähnlich oder sogar identisch sind.
Schon bei der Diskussion über die Schwachstellen der Wirkungsmechanismen gängiger Antidepressiva wurde mit Einwand 10 kritisiert, dass diese auch in nicht betroffenen Bereichen unerwünschte Aktivitäten und Nebenwirkungen entfalten. In Einwand 14 wird darauf hingewiesen, dass andere hirnorganische Begründungen einer Affektstörung nicht berücksichtigt werden. Einer dieser Gründe könnte in der Erkrankung unterschiedlicher Hirnareale liegen, die funktional mit Affekten im Zusammenhang stehen.
Die Ursachen einer Depression beruhen aus dieser Perspektive eher auf der Erkrankung bestimmter Hirnareale. Im folgenden Abschnitt werden Hirnregionen identifiziert, die mit der Entstehung und Steuerung von Affekten im Zusammenhang stehen.
1.3.1 Die verschiedenen Gehirnareale und ihre Funktionen
Das Gehirn eines Menschen hat ungefähr 100 Milliarden Nervenzellen mit einer unüberschaubaren Verflechtung untereinander. Jede Nervenzelle kann bis zu 10.000 Verbindungen zu anderen Nervenzellen unterhalten. Dazu kommt noch eine je nach Hirnareal zehn- bis zu fünfzigfach höhere Anzahl von Gliazellen. Einige Wissenschaftler und Philosophen bezeichnen das Gehirn als die „komplexeste Struktur des Universums“, was jedoch ziemlich vermessen ist, da bisher hauptsächlich irdische Strukturen einigermaßen bekannt sind.
Das komplexeste Gebilde im Universum?
Dass ein Gehirn ein kompliziertes Organ ist, steht außer Zweifel. Es hilft aber nicht weiter, sich davon entmutigen zu lassen, denn es besteht in erster Linie aus den beiden oben genannten Zellarten. Und beide Zellarten ‑ Neuronen und Gliazellen ‑ haben nur eine einzige Aufgabe: für eine korrekte Reizverarbeitung, das heißt Reizentstehung, ‑weiterleitung und ‑übertragung, zu sorgen. Bestimmte Gliazellen, wie Astrozyten, sind sogar zur Neurogenese fähig, woraus neue Nervenzellen hervorgehen. Natürlich sind auch Nebenaspekte bei jeder ganzheitlichen Betrachtung zu beachten, beispielsweise die Blutgefäßzellen des Gehirns, die mit ihrer Versorgungsfunktion indirekt ebenfalls der Reizverarbeitung dienen. Die Hauptakteure des Gehirns sind aber Nerven- und Gliazellen.
Warum sind die Erfolge im Verständnis und in der Behandlung neurologisch-psychiatrischer Erkrankungen so dünn gesät? Liegt eine Ursache vielleicht auch an übertriebenen Ängsten und übertriebenem Respekt vor der scheinbar undurchschaubaren Komplexität des Untersuchungsobjekts? Steht dem Fortschritt entgegen, dass im Hinterkopf jedes Menschen, der sich mit dieser Thematik beschäftigt, immer der Mythos vom „komplexesten Gebilde des Universums“ herumgeistert und seinen Geist hemmt?
Aber wie sieht die Realität abseits des Mythos vom „komplexesten Gebilde des Universums“ aus? Betrachtet man Hirnpräparate, beispielsweise Hirngewebeschnitte, fällt die Uniformität der „grau-weißen Masse“ sofort auf. Berücksichtigt man diese Gleichförmigkeit (→ Abbildung 1) bei der Beurteilung hunderter offizieller Klassifizierungen unterschiedlicher neurologisch‑psychiatrischer Erkrankungen, die eine ähnlich große Anzahl unterschiedlicher Erkrankungsursachen suggerieren, stellt sich doch folgende Frage: Wie sollen so viele verschiedene Erkrankungen und Ursachenhypothesen eigentlich begründet werden, wenn das Gehirngewebe letztlich doch ziemlich uniform ist?
ABBILDUNG 1: EIN HIRNSCHNITT (LATERAL)
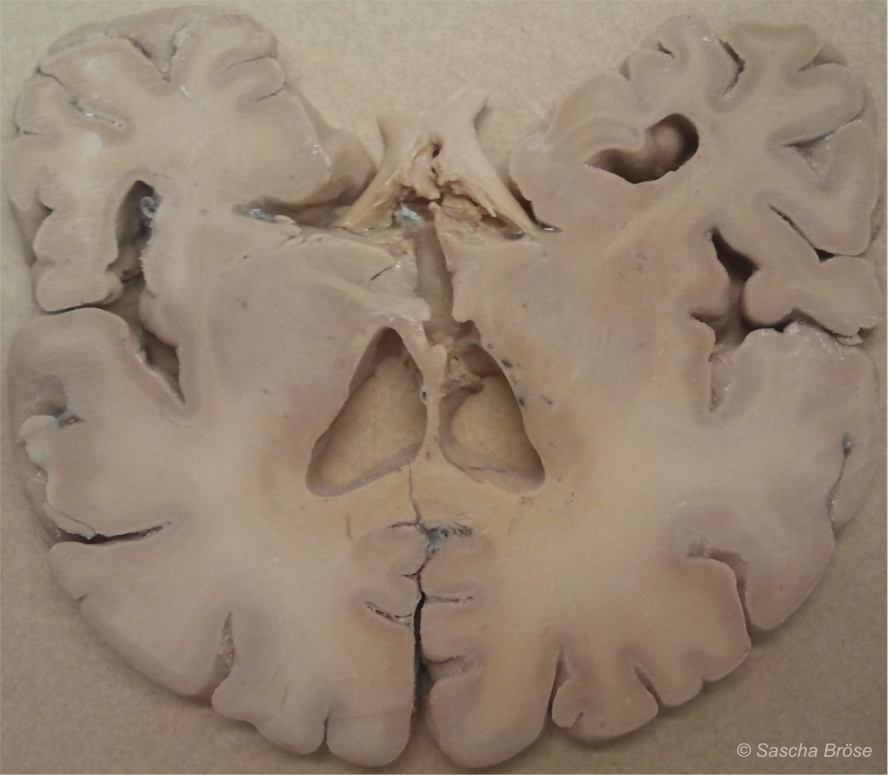
Abbildung 1: Ein Schnitt durch das menschliche Gehirn. Deutlich zu erkennen sind die Hirnwindungen mit den außenliegenden, grauen Bereichen der Nervenzellen. Zwar gibt es eine Menge verschiedener Subtypen von Nervenzellen, in Aufbau und Funktion sind sie grundsätzlich jedoch alle fast identisch. Davon zu unterscheiden ist die innere Substanz der Nervenleitungen (Axone) mit ihren myelinbildenden Gliazellen, die wesentlich heller ist und deshalb „weiße Substanz“ genannt wird. Verglichen mit anderen Organen, beispielsweise einer Niere oder einem Lungenflügel, sieht das zentrale Nervensystem klar strukturiert und aufgeräumt aus, die zerfurchte Struktur entsteht nur aus Platzgründen, denn auf diese Weise konnte die Natur sehr viele Nerven- und Gliazellen auf kleinstem Raum unterbringen. Der ICD-10-Katalog unterscheidet in zwei Kapiteln dennoch knapp 200 Grobkategorien von Erkrankungen mit zahlreichen Unterkategorien, die fast alle das Gehirn betreffen. Sollte man daraus den Schluss ziehen, dass es auch ebenso zahlreiche Erkrankungsursachen auf der primären Organebene gibt? Nein, denn die Uniformität des Gehirngewebes zeigt: Die Gründe können nur auf relativ wenigen grundsätzlichen Fehlfunktionen der Nerven- und Gliazellen beruhen, so dass die unterschiedlichen Hirnregionen dann ausschlaggebend dafür sind, welche Symptome sich manifestieren und vom Patienten wahrgenommen werden. Das ist vergleichbar mit einem Multiplikatoreffekt, der leider unzählige Erkrankungsursachen auf der (primären) Organebene suggeriert, die es aber nicht gibt. So gerät man schnell auf eine falsche Fährte.
Zuviel übertriebene Ehrfurcht vor dem Gehirn ist kontraproduktiv und schadet nur, denn sie behindert die Möglichkeit, zu neuen Erkenntnissen zu gelangen und macht blind für die wesentlichen Zusammenhänge. Das Gehirn soll nun einmal bewusst respektlos als ein „großer Zellklumpen“ betrachtet werden, um besser herausfinden zu können, ob Nervenerkrankungen nicht eigentlich auf viel grundlegenderen Fehlentwicklungen beruhen als bisher angenommen.
Und: Könnte das Übersehen grundlegender Fehlentwicklungen nicht eine Ursache dafür sein, dass es in der medizinischen Standardbehandlung vieler neurologisch-psychiatrischer Erkrankungen kaum Fortschritte gibt, obwohl Menschen Ende der 1960er Jahre auf dem Mond landeten oder in der Lage sind, auf einem daumennagelgroßen Siliziumbauteil immer noch weitere Milliarden elektronischer Bauteile unterzubringen? Plausible Thesen oder Fakten über die Entstehung von Hirnerkrankungen haben Seltenheitswert ‑ und das bei der übergroßen Anzahl der ICD‑10‑Diagnosen. Im Grunde wird das Gehirn von vielen noch heute als „Black‑Box“ betrachtet.
Natürlich gibt es noch weitere Faktoren, die kontraproduktiv wirken und den Fortschritt hemmen. So spielt auch die Zersplitterung der Nervenheilkunde in viele verschiedene Fachgebiete eine Rolle. Auch eine detailbesessene Forschung führt zum Verlust von Übersicht und Ressourcen und verringert die Chancen, zu nutzenstiftenden Ergebnissen zu kommen. Eine unbestreitbar notwendige Grundlagenforschung verzettelt sich oft in Einzelheiten, so dass die große Gesamtsicht auf der Strecke bleibt. Die Raumfahrttechnologen hätten es wahrscheinlich nicht weit gebracht, wenn sie ebenso vorgegangen wären. Denn man muss nicht die Rückseite des Mondes im Maßstab 1 : 1.000 kartographieren, um auf der anderen Seite zu landen.
Sinnvoll ist ein einfaches Funktionsmodell des Zentralnervensystems, das eine Übersicht der Hirnareale ermöglicht und geeignet ist, bestimmte Regionen als entscheidend für die Entstehung oder den Verlauf einer bestimmten Nervenerkrankung zu identifizieren.
Im Laufe langjähriger Untersuchungen konnten verschiedenen Hirnbereichen bestimmte Funktionen zugeordnet werden, obwohl aufgrund der Verschaltung der Regionen untereinander eine eindeutige Aufgabentrennung nicht immer möglich ist. Es hat sich jedoch gezeigt, dass vieles dennoch relativ zuverlässig lokalisierbar ist.
Das verschiedenen Hirnregionen in der Übersicht
Im Folgenden werden alle wichtigen Hirnregionen und Strukturen vorgestellt:
- Großhirnhemisphären
- Äußerer und innerer Cortex
- Großhirnkerne einschließlich der Basal- bzw. Stammganglien
- Zwischenhirn
- Thalamus
- Hypothalamus
- Hypophyse
- Zirbeldrüse (Epiphyse)
- Stammhirn
- Mittelhirn (Mesencephalon)
- Medulla oblongata (Unteres Stammhirn)
- Kleinhirn
- Cerebellum (Kleinhirn im engeren Sinne)
- Pons (Brücke)
- Formatio reticularis (ARAS)
- ARAS, ein Teil der Formatio reticularis, ist eine entscheidende Hirnzellenstruktur des Stamm- und Zwischenhirns mit Nervenbahnen in viele Hirnregionen
Großhirnhemisphären
Das Großhirn ist die komplexeste Hirnregion und nimmt ca. 80% des Hirnvolumens eines Menschen ein. Man unterscheidet zwei funktionale Teilbereiche: die stammesgeschichtlich jüngere Großhirnrinde (auch „Cortex“ genannt) und die älteren Großhirnkerne, die unterhalb der Großhirnrinde angeordnet sind. Beide bilden zusammen die Großhirnhemisphären.
Die äußere Großhirnrinde steuert die höheren Funktionen, beispielsweise Intellekt oder Persönlichkeit. Teile der inneren Großhirnrinde und verschiedene Großhirnkerne stellen im Schwerpunkt große Teile des Emotionszentrums dar, welches vor allem für Gefühle, Angst, Stressverarbeitung und Antrieb zuständig ist. Einige Großhirnkerne übernehmen auch Funktionen der Motorik oder sind an der Steuerung anderer Körperfunktionen beteiligt.
Bestimmte kognitive/intellektuelle Leistungen (zum Beispiel die Erinnerungs- und Konzentrationsfähigkeit) erfolgen in spezialisierten Großhirnkernen, die gleichzeitig auch für die Emotionsverarbeitung zuständig sind. Unterstellt man, dass Dysfunktionen dieser Areale mit einer Depression in einem Zusammenhang stehen, ist es nicht verwunderlich, dass viele Betroffene gleichzeitig über Konzentrationsunfähigkeit und eine verminderte Merkfähigkeit klagen.
Äußere und innere Großhirnrinde (Cortex)
In der äußeren Großhirnrinde werden in den folgenden Arealen die jeweils beschriebenen Aktivitäten gesteuert. Diese Aktivitäten repräsentieren den ersten großen Funktionsbereich des Gehirns, der hauptsächlich für bewusstes Erleben, Intellekt und Persönlichkeit zuständig ist.
- Primäres sensorisches Sinnesareal:
Zuständig für die erste Verarbeitung von Tast-, Geruchs- und Geschmacksempfindungen.
- Primäres motorisches Sinnesareal:
Zuständig für das willentliche Ausführen von Bewegungen des gesamten Körpers ohne den feinmotorischen Anteil.
- Primäres visuelles Sinnesareal:
Zuständig für die erste Verarbeitung der visuellen Wahrnehmung von Formen und Farben.
- Primäres auditives Sinnesareal:
Zuständig für die erste Verarbeitung akustischer Wahrnehmungen von Tönen bzw. Geräuschen.
- Sekundäres sensorisches, motorisches, visuelles und auditives Sinnesareal:
Dort werden Informationen der primären Areale weiterverarbeitet und bewusst gemacht. Zu jedem der beschriebenen vier primären Sinnesareale gibt es parallel ein sekundäres Sinnesareal.
- Assoziationsareal:
Hier werden weitere hochkomplexe Fähigkeiten (mit-)gesteuert, zum Beispiel Persönlichkeit, Bewusstsein, Kreativität, soziales Verhalten etc. Die Bereiche des präfrontalen Cortex und der Frontallappen sind eng mit Bereichen der Basalganglien und dem nachfolgend beschriebenen emotionalen System des Großhirns verbunden. Daher ist die Wahrscheinlichkeit einer Beteiligung an emotionalen Prozessen hoch. Vermutlich werden die Signale aus den Bereichen des Zwischenhirns und der unteren Großhirnareale im Assoziationsareal bewusst gemacht, bewertet und somit intellektualisiert.
Zum Cortex gehört nicht nur die äußere Großhirnrinde, auch die beiden Areale des Gyrus cinguli und Gyrus parahippocampalis sind als Bereiche der inneren Großhirnrinde jeweils Teil des Cortex.
- Gyrus cinguli (Cingulärer Cortex):
Dieses relativ große Areal scheint vor allem an der bewussten Wahrnehmung von Gefühlen beteiligt zu sein, die in den ihm vorgelagerten Großhirnkernen autonom entstehen. So gibt es beispielsweise Verbindungen mit dem Mandelkern, die eine Steuerung dessen Aktivitäten durch den cingulären Cortex ermöglichen (→ Großhirnkerne).
- Gyrus parahippocampalis:
Auch der benachbarte Gyrus parahippocampalis könnte, auch aufgrund der räumlichen Nähe zum Gyrus cinguli, an der Verarbeitung von Affekten beteiligt sein. In der Literatur werden dessen Funktionen jedoch hauptsächlich im Zusammenhang mit Gedächtnisfunktionen, dem visuellen Erkennen der Umgebung oder dem Verstehen sozialer Zusammenhänge beschrieben.
Neben dem Assoziationsareal und dem Gyrus cinguli gibt es in anderen höheren Cortex-Bereichen vielleicht weitere Areale, die Emotionen bewusst machen und bewerten und in direkter Verbindung mit den tiefer lokalisierten Hirnbereichen stehen, zum Beispiel mit Hilfe der unten beschriebenen Formatio reticularis. Es ist auch eine interessante Frage, ob kognitive und emotionale Bereiche scharf voneinander abgegrenzt sind oder der Übergang fließend verläuft. Aber das kann derzeit nicht mit Sicherheit beantwortet werden.
Gyrus cinguli, Gyrus parahippocampalis und die affektiven Anteile des Assoziationsareals werden wegen ihrer Beteiligungen an emotionalen Vorgängen daher einem großen Funktionsbereich des Zentralnervensystems, dem emotionalen System, zugeordnet.
Großhirnkerne (außer Basal- bzw. Stammganglien)
Zum emotionalen System zählen auch die Großhirnkerne Hippocampus mit Fornix und Corpus mamillare und der Mandelkern (Amygdala). Die Kerne sind in jeder der beiden Großhirnhemisphären links und rechts vorhanden, treten also als Paar auf. Die schon erwähnten Cortex-Areale Gyrus cinguli und Gyrus parahippocampalis bilden einen Ring um diese Großhirnkerne.
In den Großhirnkernen werden Affekte gesteuert und reguliert, ohne dass sie auf dieser Stufe schon bewusst werden; dies geschieht erst in den oben beschriebenen Cortex-Bereichen.
Die Großhirnkerne sind von der Entwicklungsgeschichte des Menschen aus betrachtet älter als der für Bewusstsein, Persönlichkeit und Intelligenz verantwortliche, verhältnismäßig junge Cortex. Einige Großhirnkerne sind aus diesem Grunde auch für die Steuerung vieler essentieller Körperfunktionen und des Gedächtnisses zuständig. Über diese Hirnstrukturen verfügten schon frühe höhere Lebewesen.
Die Strukturen der Großhirnkerne sind wesentlich filigraner und differenzierter im Verhältnis zur uniform aufgebauten Großhirnrinde.
Steuerung und Regulierung der Körperfunktionen einschließlich Bewegung/Motorik und Gedächtnis bilden einen weiteren großen Hirnfunktionsbereich.
- Hippocampus mit Fornix:
Der Hippocampus ist die zentrale Schaltstelle des emotionalen Systems und hat umfangreiche Funktionen. Er sorgt mit dem Fornix für die Übertragung von Informationen an das Langzeitgedächtnis.
An der Entstehung von Aufmerksamkeit, sozialem Verhalten, der Verarbeitung von Angst und der Körperwahrnehmung ist der Hippocampus ebenfalls beteiligt. Seine (Mit‑)Verantwortung für die Entstehung oder Verarbeitung von Affekten ist wahrscheinlich.
Obwohl es als sicher gilt, dass weitere Areale zur Neurogenese fähig sind und neue Nervenzellen hervorbringen, ist diese Funktion für den Hippocampus sehr gut belegt. Neben seiner Aufgabe, Erinnerungen zwischenzuspeichern und weiterzuleiten, wofür eine Neurogenese unabdingbar ist, könnte der Hippocampus damit auch an der Reparatur des Hirngewebes in anderen Arealen beteiligt sein.
- Mandelkern:
Der auch als Amygdala bezeichnete Hirnkern ist zentral für die Entstehung und Verarbeitung von Angst und Affekten zuständig bzw. ‑ zusammen mit dem Hippocampus ‑ ursächlich verantwortlich.
- Corpus mamillare:
Dieser Kern wird auf Deutsch Mamillarkörper genannt. Leider sind Kenntnisse über seine Aufgaben sehr begrenzt. Früher hat man ihm Funktionen in der Emotionsverarbeitung unterstellt. Forschungen deuten jedoch darauf hin, dass er zusammen mit Hippocampus und Fornix ausschließlich wichtige Funktionen bei Gedächtnisvorgängen übernimmt. Die paarigen Mamillarkörper sind anatomisch mit Hippocampus und Fornix verbunden.
Basal- oder Stammganglien
Die Basal- oder Stammganglien gehören ebenfalls zu den älteren Großhirnkernen. Das Verständnis über ihre Bedeutung ist auch hier noch beschränkt.
Ihnen werden mannigfaltige Funktionen unterstellt. Früher dachte man nur an die willkürliche (Grob-)Motorik. Heute ist bekannt, dass sie auch an emotionalen Vorgängen beteiligt sind, unter anderem an Affekten, Antrieb oder Willenskraft. Ein Beispiel ist der Nucleus accumbens als Teil des „Belohnungszentrums“ mit seinen vielen Dopaminrezeptoren, der unter anderem bei der Entstehung von Suchterkrankungen eine Rolle spielt.
Ein weiteres Basalganglienareal, das Corpus striatum, scheint ebenfalls im Zusammenhang mit Affekten und Antrieb eine Rolle zu spielen. So basiert Chorea Huntington, eine schwere neurodegenerative Erkrankung mit Störungen der Grob- und Feinmotorik als Hauptsymptomatik, vor allem auf der Zerstörung des Corpus striatum und geht auch mit Affekt- und Antriebsstörungen einher.
Eine weitere Aufgabe der Basalganglien besteht in der Weiterleitung von Sinneseindrücken aus den Großhirnarealen an den Thalamus (→ Zwischenhirn).
Zwischenhirn
Das Zwischenhirn hat drei Bestandteile: Thalamus, Hypothalamus und Hypophyse. Das Zwischenhirn bedient mit der Emotions- bzw. Aufmerksamkeitssteuerung und der Körperfunktionssteuerung ebenfalls zwei Funktionsbereiche des Gehirns.
- Thalamus:
Sinnbildlich als „Tor zum Bewusstsein“ bezeichnet. Nervenreize aus dem Körper werden hier autonom bewertet und an die zuständigen Hirnrindenareale weitergeleitet („umgeschaltet“). Der Thalamus entscheidet damit, welche Reize mit welcher Intensität in der Großhirnrinde bewusst wahrgenommen werden. Er trifft seine Entscheidungen mit Hilfe von Informationen aus anderen Hirnarealen, die ihn ständig darüber informieren, was gerade wichtig ist. Somit findet auf der Thalamus-Ebene eine erste unbewusste Informationsverarbeitung statt.
Narkotika wirken oftmals in dieser Gehirnregion. Interessant ist außerdem, dass viele Opiatrezeptoren im Thalamus zu finden sind. Fehlsteuerungen des Thalamus werden sowohl mit der Schizophrenie bzw. Psychosen als auch der Manie in Verbindung gebracht.
Insbesondere die Nuclei anterioventrales des Thalamus werden zum emotionalen System gezählt.
- Hypothalamus und Hypophyse:
Der Hypothalamus ist unterhalb des Thalamus angehängt, die Hypophyse liegt am Ende des Hypothalamus. Letzterer ist das wichtigste Steuerzentrum des vegetativen Nervensystems mit seinen nicht willentlich beeinflussbaren autonomen Regelkreisen. Beispiele sind die Regulation von Körpertemperatur und Blutzuckerspiegel, die Steuerung der Nahrungsaufnahme und die Schlafregulation. Gemeinsam mit der Hypophyse steuert er auch die Hormonregulation. Daher spricht man von der Hypothalamus-Hypophysen-Achse, deren Störungen erhebliche Auswirkungen auf den emotionalen und körperlichen Gesundheitszustand haben.
Zirbeldrüse (Epiphyse cerebri)
Die an der Oberseite des Thalamus liegende kleine Drüse ist für die Produktion des Hormons Melatonin verantwortlich, das in der Nacht bzw. bei Dunkelheit verstärkt produziert wird und an der Steuerung des Tag-Nacht-Rhythmus erheblich beteiligt ist. Melatonin stellt eine Vorstufe des Neurotransmitters Serotonin dar, und Fehlsteuerungen der Epiphyse werden mit der sogenannten „Winterdepression“ bzw. Saisonalen Depression (SAD) in Zusammenhang gebracht. Eine gestörte Melatoninproduktion führt eventuell zu Störungen des Schlafrhythmus.
Die Epiphyse wird in der Literatur manchmal dem Zwischenhirn zugeordnet.
Mittelhirn (Oberes Stammhirn oder Mesencephalon)
Die relativ kleine Hirnregion ist in eine Vielzahl von Kernen differenziert und steuert vor allem vegetative Bewegungsabläufe. Ebenfalls werden Impulse der Augen bzw. Ohren und von Oberflächenrezeptoren der Haut an andere Hirnbereiche weitergeleitet. Eine Funktion des Mittelhirns besteht daher auch in der Sinnes- oder Schmerzwahrnehmung.
Die wichtigsten Mittelhirnkerne sind: Nucleus ruber (rote Substanz) und die Substantia nigra (schwarze Substanz). Eine Erkrankung der Substantia nigra ist hauptsächlich für Morbus Parkinson verantwortlich, hier wird ein großer Teil des wichtigen Neurotransmitters Dopamin produziert. Der Neurotransmitter Dopamin ist auch an der Steuerung von Antrieb bzw. Aktivitätsdrang beteiligt.
Die weiter unten beschriebene Formatio reticularis führt ihre aufsteigenden Nervenbahnen u. a. vom Mittelhirn zum Nucleus accumbens der Basalganglien. Die als mesolimbische Bahn bezeichnete Verbindung startet im Tegmentum des Mittelhirns, das auch als Mittelhirnhaube bezeichnet wird (→ Abschnitt Formatio reticularis).
Die zur Formatio reticularis zählenden Raphe-Kerne des Mittelhirns sind darüber hinaus eine Lokalisation der Serotonin-Produktion. Es wird vermutet, dass der Neurotransmitter Serotonin an der emotionalen Steuerung, beispielsweise der Regulation der Stimmungslage, einen Anteil hat. Allerdings gibt es gegenteilige Meinungen über die Funktionen des Monoamins Serotonin. Viele Mediziner und Forscher vermuten, dass Serotonin im Zusammenhang mit Affektstörungen eher eine nebensächliche Rolle spielt. Das zeigt sich auch in der kontroversen Diskussion über die Wirksamkeit von Antidepressiva, welche die Serotonin-Wiederaufnahme im synapthischen Spalt der Neuronen hemmen (→ Abschnitt 1.1 f.).
Medulla oblongata (Unteres Stammhirn bzw. Verlängertes Mark)
Direkt oberhalb des Rückenmarks beginnt übergangslos die Medulla oblongata und markiert den Beginn des Gehirns. Auch hier werden ‑ wie beim Mittelhirn ‑ nicht willentlich beeinflussbare (autonome) Regelkreise gesteuert, beispielsweise der Blutkreislauf, die Atmung oder der Niesreflex. Eine direkte Beteiligung dieser Hirnregion an emotionalen Vorgängen ist so gut wie ausgeschlossen.
Da das aufsteigende retikulär-aktivierende System (ARAS) seinen Ursprung zum Teil auch im unteren Stammhirn hat (→ Abschnitt Formatio reticularis) und die dort befindlichen Raphe-Kerne ‑ wie auch die Raphe‑Kerne des Mittelhirns ‑ für die Synthese des Neurotransmitters Serotonin mitverantwortlich sind, würden Teile der Medulla oblongata die Entstehung und Steuerung von Emotionen vielleicht beeinflussen, sofern ‑ siehe oben ‑ Serotonin hier überhaupt eine Bedeutung hat. Es hinge davon ab, auf welche Weise Serotonin emotionale Vorgänge generell beeinflusst und ob das in der Medulla oblongata synthetisierte Serotonin dabei überhaupt eine Rolle spielt (→ Abschnitt 1.1 f.).
Kleinhirn mit Brücke
Obwohl es Diskussionen über eine Beteiligung des Kleinhirns an kognitiven Fähigkeiten gibt, wird dieser Teil des Gehirns in erster Linie mit der Feinsteuerung von Bewegungsabläufen (Feinmotorik) und der Steuerung des Gleichgewichts in Verbindung gebracht. Erlernte Bewegungsabläufe, zum Beispiel das Radfahren oder das Spielen eines Musikinstruments, sind hier gespeichert.
Störungen des Kleinhirns führen daher zu einem Verlust der Bewegungskoordination, nicht jedoch zum Ausfall der Bewegungsabläufe und äußern sich dann in ungelenk wirkenden Bewegungen oder Sprechstörungen, sofern die grobmotorischen Zentren des Großhirns (= Basalganglien) noch ausreichend aktiv sind.
Die Brücke (Pons) bildet mit dem Kleinhirn eine Einheit. Sie liegt zwischen Mittelhirn und Medulla oblongata und leitet die Nervenimpulse aus den Großhirnhemisphären an die Kleinhirnregionen weiter.
Neueste Forschungen vom März 2022 zeigen, dass das Kleinhirn mit verschiedenen Bereichen des Großhirns kommuniziert und bei der Abspeicherung emotionaler Eindrücke vermutlich eine Rolle spielt (Quelle: Matthias Fastenrath et al., Human cerebellum and corticocerebellar connections involved in emotional memory enhancement, University of California Irvine, Irvine, USA, https://www.pnas.org/doi/...). Es könnten daher in Zukunft noch weitere Funktionen des Kleinhirns entdeckt werden, die bei der Emotionsverarbeitung eine Rolle spielen und die Sicht auf diesen Teil des Gehirn verändern.
Eine Beteiligung von Kleinhirn und Brücke an der Entstehung und Verarbeitung von Emotionen ist daher nicht ganz auszuschließen aber aus heutiger Sicht eher unwahrscheinlich.
Formatio reticularis (ARAS)
Interessant ist die Formatio reticularis als ein diffuses und schwierig abzugrenzendes Nervennetz des Hirnstamms und des Zwischenhirns. Sie ist daher Bestandteil sowohl von Thalamus, Mittelhirn und Medulla oblongata. Ihre absteigenden Neuronen dringen bis ins Rückenmark vor, ebenfalls bestehen Verbindungen in das Kleinhirn. Ihre aufsteigenden Neuronen und Neuronenfortsätze führen über das Zwischenhirn und Mittelhirn sogar bis in Großhirnregionen (→ Beschreibung Mittelhirn). Die Formatio reticularis stellt eine der wichtigsten Nervenverbindungsstrukturen dar, die unterschiedliche Hirnbereiche miteinander verknüpft.
Die aufsteigenden Nervenbahnen erzeugen das Erregungsniveau für den Wachzustand. Dieser Teil der Formatio reticularis wird daher auch als aufsteigendes retikulär‑aktivierendes System (ARAS) bezeichnet. Ohne ein funktionierendes ARAS ist kein Bewusstsein möglich.
Die Formatio reticularis ist auch für die komplexe Verarbeitung von Sinneseindrücken und Emotionen zuständig. Letztere erfolgt durch die Verknüpfung von Bereichen des Hypothalamus und des Mittelhirns mit den emotionalen Zentren der Basalganglien, dort vor allem mit dem Nucleus accumbens.
Neuroforscher sehen daher im Verständnis der Funktionen der Formatio reticularis und insbesondere des ARAS den Schlüssel zur Erforschung nicht nur dessen, was unter Bewusstsein im neurologischen Sinne als Wachzustand verstanden wird, sondern auch des phänomenal-gedanklichen Bewusstseins und des Individualitätsbewusstseins, also jener Phänomene, die das erlebbare Sein betreffen.
Übersicht der verschiedenen Hirnareale
Die nachfolgende Graphik stellt das Gehirn schematisch in der Übersicht dar, die nicht die tatsächlichen Größenverhältnisse der Areale oder deren Lage korrekt abbildet.
ABBILDUNG 2: DIE VERSCHIEDENEN HIRNAREALE („GEHIRNLANDKARTE“)
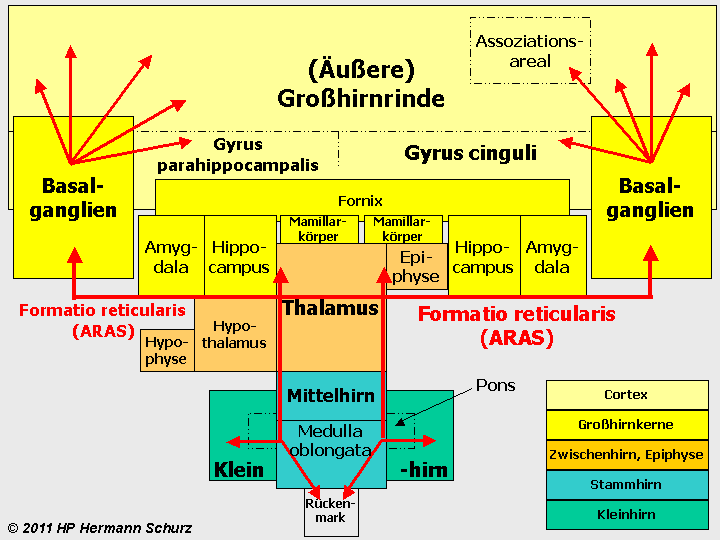
Abbildung 2: Eine schematische Darstellung der verschiedenen Hirnregionen. Das Rückenmark ist Teil des zentralen Nervensystems (ZNS) aber nicht Bestandteil des Gehirns, das übergangslos mit der Medulla oblongata beginnt. Hellgelb: Großhirnrinde; Dunkelgelb: untere Großhirnkerne; Orange: Zwischenhirn (einschließlich Hypophyse) und Epiphyse; Türkisblau: Stammhirn; Grün: Kleinhirn mit Brücke (Pons). Die Nervenbahnen der Formatio reticularis (rote Pfeillinien) sind vor allem im Tegmentum des Mittelhirns und im Thalamus lokalisiert, reichen aber als aufsteigendes, retikulär‑aktivierendes System (ARAS) über die Basalganglien (dort vor allem im Nucleus accumbens) bis in verschiedene Regionen der Großhirnrinde. Nach unten führen die Bahnen der Formatio reticularis bis ins Kleinhirn bzw. Rückenmark.
1.3.2 Gehirnareale, die bei einer Depression betroffen sind und eine dritte These
Anhand der Gehirnlandkarte (→ Abbildung 2) und den Arealfunktionsbeschreibungen werden jetzt die Bereiche markiert, die im Zusammenhang mit Affekten/Emotionen, Angstverarbeitung oder Antrieb stehen.
Auf dieser Basis erfolgt auch eine grobe Bewertung des Beteiligungsgrads und der Rangfolge der einzelnen Bereiche an emotionalen Vorgängen. Damit ergibt sich automatisch auch eine Rangfolge der Beteiligung des jeweiligen Bereichs an der Entstehung einer Affekterkrankung im Falle von Funktionsstörungen.
In seiner Gesamtheit stellt das markierte Areal das emotionales System des zentralen Nervensystems dar. Die Gewichtung einzelner Areale ist zwar sekundär und spekulativ, jedoch nachvollziehbar. In Abbildung 3 werden die Areale gemäß ihrer vermuteten Rangfolge mit den Farben Schwarz, Grau und Hellgrau gekennzeichnet.
- Schwarz:
Die schwarz markierten Gehirnregionen sind primär für die autonome Entstehung, Verarbeitung bzw. Steuerung oder Wahrnehmung von Affekten, Emotionen, Ängsten und Antrieb zuständig. Das trifft für einen Teil des unteren Cortex und einige Großhirnkerne mit den Bezeichnungen Gyrus cinguli, Hippocampus mit Fornix und Amygdala zu.
- Dunkelgrau:
Die dunkelgrau markierten Gehirnregionen sind sekundär für die autonome Entstehung, Verarbeitung oder Steuerung von Affekten, Emotionen, Ängsten und Antrieb verantwortlich. Das betrifft die Basalganglien und das obere Zwischenhirn (Thalamus).
- Hellgrau:
Die Gehirnregionen Hypothalamus, Hypophyse, Epiphyse cerebri und das Assoziationsareal der äußeren Großhirnrinde beeinflussen die autonome Entstehung, Verarbeitung oder Wahrnehmung von Affekten und hellgrau markiert. Emotionen, Ängsten und Antrieb. Die Beteiligung der Epiphyse ist unklar, der Autor hat sich entschlossen, diese Region dennoch einzubeziehen. Da Nervenbahnen der Formatio reticularis vom oberen Mittelhirn über den Nucleus accumbens der Basalganglien bis in Cortex-Regionen reichen und dort auch die Hauptproduktionsstätte des Dopamins lokalisiert ist, wird das Mittelhirn ebenfalls zum emotionalen System gezählt.
- Weiß:
Die weiß belassenen Bereiche sind nach dem jetzigen Stand (März 2023) an der Entstehung und Verarbeitung von Affekten, Emotionen, Ängsten und Antrieb mit hoher Wahrscheinlichkeit unbeteiligt. Beim Gyrus parahippocampalis und den Mamillarkörpern symbolisieren die Fragezeichen einen Rest von Unklarheit in dieser Frage. Da in den Raphe-Kernen der Medulla oblongata ein Teil des Serotonins produziert wird, könnten diese Kerne ebenfalls für die Entstehung und Verarbeitung von Emotionen eine Rolle spielen, wobei die genaue Funktion des Serotonins noch ungeklärt ist. Daher ist auch die Medulla oblongata mit einem Fragezeichen versehen.
ABBILDUNG 3: DIE AFFEKTIV-EMOTIONALEN GEHIRNAREALE (FUNKTIONSMODELL)
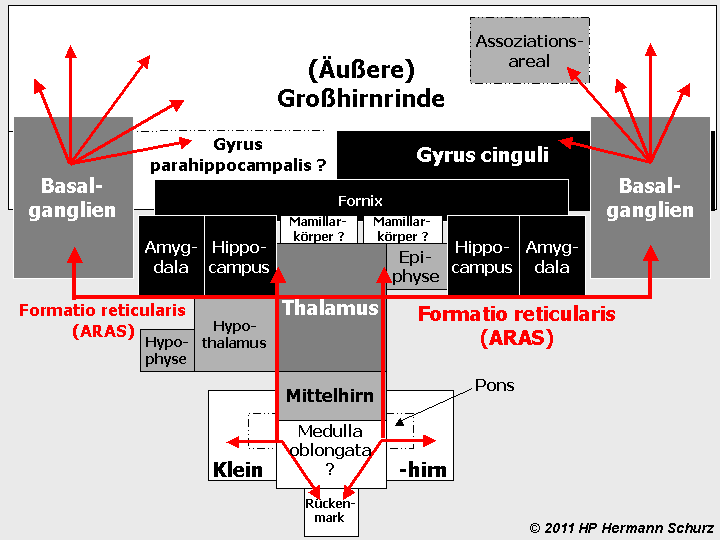
Abbildung 3: Eine Darstellung der Hirnregionen mit den für Affekte, Antrieb und Angstverarbeitung zuständigen Bereichen. Alle dunkel markierten Areale sind hier involviert - je dunkler das Areal ist, desto stärker ist es an Entstehung, Verarbeitung und Wahrnehmung dieser Hirnleistungen beteiligt. Einen starken Anteil haben Gyrus cinguli, Amygdala, Hippocampus und Fornix (Schwarz). Von einer mittelgradigen Beteiligung ist bei den Basalganglien und dem Thalamus auszugehen (Dunkelgrau), während Hypophyse, Hypothalamus und Epiphyse durch ihre autonomen Steuerungsaufgaben beteiligt sind (Hellgrau). Das Kleinhirn mit Brücke und das nicht zum Gehirn zählende Rückenmark sind unbeteiligt. Je dunkler die markierten Bereiche sind, desto größer ist deren Bedeutung für Affekte. Mamillarkörper und Gyrus parahippocampalis sind aufgrund ihrer unsicheren Zuordnung jeweils mit einem Fragezeichen versehen, sind jedoch höchstwahrscheinlich nicht an Affekten beteiligt. Ähnliches gilt für die Medulla oblongata, denn deren Raphe-Kerne sind ein Ort der Serotonin-Produktion und zählen zur Formatio reticularis, die fast alle emotionalen Bereiche durchzieht. Bei Funktionsstörungen in Arealen, die mit der Formatio reticularis in einem Zusammenhang stehen, kann es zu Unterbrechungen wichtiger Reizweiterleitungen kommen.
Analyse und Bewertung lassen als Schlussfolgerung nur die nachfolgende dritte These zu:
- Depressionserkrankungen beruhen auf Dysfunktionen der für Affekte zuständigen Hirnareale.
Bei einer affektiven Störung sind
- primär die Hirnregionen Gyrus cinguli, Hippocampus mit Fornix und Amygdala (Mandelkern),
- sekundär die Basalganglien, der Thalamus und das Assoziationsareal und
- tertiär die Hypothalamus-Hypophysen-Achse, die Epiphyse cerebri und das Mittelhirn von den in den Thesen 1 und 2 beschriebenen Funktionseinschränkungen betroffen.
Die wichtigen oberen Verbindungsbahnen der Formatio reticularis (ARAS) führen durch fast alle affektiv involvierten Hirnregionen und sind in einem besonderen Maße an Affekten (und daraus folgernd bei Affektstörungen) involviert. Funktionseinschränkungen einzelner Areal haben durch die Verknüpfung der Formatio reticularis einen direkten negativen Einfluss auf alle untereinander verbundenen Areale.
Ein Zusammenhang der Fehlsteuerungen bestimmter Gehirnregionen mit der Entstehung von Psychosen als weiterem Merkmal affektiver Erkrankungen ist wahrscheinlich. Das betrifft zum Beispiel das Assoziationsareal oder das für die Filterung von Sinneseindrücken zuständige obere Zwischenhirn (Thalamus).
Es ist nicht zwingend, dass alle oder eine bestimmte Anzahl von Hirnbereichen an einer Affektstörung beteiligt sein müssen. Die Funktionseinschränkung könnte auch nur ein Areal betreffen. Ebenfalls ist die Wahrscheinlichkeit hoch, dass der Grad der Funktionseinschränkung überall unterschiedlich ist, sofern mehrere Bereiche involviert sind. Auch die Verbindungsfunktion der Formatio reticularis, die von zentraler Bedeutung ist, erschwert Zuordnungen und klare Abgrenzungen bzw. macht solche Überlegungen obsolet.
Weiter ist die Größe der Hirnareale wichtig, um deren Einfluss auf das Erkrankungsniveau einschätzen zu können. Man muss sich darüber im Klaren sein, dass wichtige Regionen, wie die des Mandelkerns, sehr klein und darüber hinaus sehr komplex strukturiert sind. Derartige Strukturen sind besonders anfällig für Störungen mit fatalen Folgen für das Gesamtsystem.
1.4 Ein dreistufiges Modell dysfunktionaler neuronaler Leistungsfähigkeit ▲
Bisher werden mit den Thesen 1 und 2 (→ Abschnitt 1.2) Fehlfunktionen von Nerven- und Gliazellen als grundsätzliche Ursachen Affektiver Störungen postuliert. Diese Fehlfunktionen führen zu Problemen der Informationsverarbeitung auf Zellebene. These 3 (→ Abschnitt 1.3) grenzt anschließend ein, welche Hirnareale mit welcher Wahrscheinlichkeit von diesen Fehlfunktionen betroffen sein müssen, damit es zu einer Depression, Manie oder Bipolarität kommen kann.
Weitere Ursachen neuronaler Störungen
Die bisherigen Annahmen ergeben aber noch kein vollständiges Modell affektiver Erkrankungen, denn weitere neuronale Leistungsmerkmale ‑ wie Neuronenvernetzung oder Hirnzellendichteanforderungen ‑ spielen bei der Informationsverarbeitungsqualität entscheidende Rollen. Störungen können demnach auch in einer unzureichenden Nervenzellenvernetzung oder einer unzureichenden Hirnzellendichte begründet sein.
Eine vollständige Definition der Ursachen eingeschänkter neuronaler Leistungsfähgkeit umfasst aus diesen Gründen vier Merkmale:
- Gestörte Neuronenaktivitäten
- Gestörte Aktivitäten der Gliazellen
- Unzureichende Neuronenvernetzung
- Unzureichende Dichte von Neuronen bzw. Gliazellen
Zusammenhänge zwischen den Ursachen eingeschränkter neuronaler Leistungsfähigkeit
Sämtliche vier Merkmale können nicht unabhängig voneinander sein. Gerade die Nervenzellenvernetzung macht deutlich, dass sich Veränderungen an einer bestimmten Stelle aufgrund der vielfältigen Verbindungen auf andere Bereiche auswirken können. Auch für die Existenz zeitlicher Zusammenhänge spricht vieles. Eine degenerative Entwicklung könnte aus dieser Perspektive durch einen kontinuierlichen Prozess charakterisiert sein, der mit Störungen einzelner Hirnzellen beginnt und mit dem kompletten Verschwinden von Nervenzellen endet. Ein solcher Prozess ließe sich als dreistufig darstellen:
- Ausreichende neuronale Leistungsfähigkeit (Stufe 0)
Nerven- und Gliazellen erfüllen ihre Funktionen vollständig und situationsangemessen. Sie weisen typische Reizverarbeitungsaktivitäten auf, unter anderem auch aufgrund einer ausreichenden Vernetzung bzw. intakter Vernetzungsmuster und einer ausreichenden Zellendichte bzw. Zellenanzahl.
- Funktionsstörungen bei Nerven- und/oder Gliazellen (Stufe 1)
Einzelne Nerven- und Gliazellen beginnen mit einer unangemessenen bzw. pathologischen Zu- oder Abnahme ihrer Aktivitäten, es kommt zu Störungen der Reizverarbeitung, Reizentstehung, Reizweiterleitung oder Reizübertragung. Im weiteren mittel- bis langfristigen Verlauf nehmen die Veränderungen ggf. kontinuierlich zu und erfassen immer mehr Zellen. Das kann in einer zweiten Degenerationsstufe münden.
- Verschlechterung der Nervenzellenvernetzung (Stufe 2)
Aufgrund zunehmender Störungen von Neuronen und/oder Gliazellen sinkt die Zahl der Neuronenverbindungen kontinuierlich.
- Abbau von Nerven- und/oder Gliazellen (Stufe 3)
In einer dritten (und letzten) Stufe stellen immer mehr Hirnzellen ihre Aktivitäten ein, und es kommt zum Zelltod (Apoptose). Im günstigsten Fall werden die abgestorbenen Zellen vom Immunsystem beseitigt, im schlimmsten Fall wird das gesunde Gewebe länger durch den abgestorbenen Zellschrott belastet.
Abbildung 4 veranschaulicht den dreistufigen Degenerationsprozess. Das 3-Stufen-Modell impliziert noch weitere Annahmen:
- Anforderungen an Zelldichte und Zellanzahl
Die mit Hilfe der Gehirnlandkarte (→ Abbildungen 2 und 3) voneinander abgegrenzten Hirnareale haben jeweils unterschiedliche Anforderungen hinsichtlich der Dichte und Anzahl von Nerven- und Gliazellen.
- Anforderungen an die Nervenzellenvernetzung
Die mit Hilfe der Gehirnlandkarte (→ Abbildungen 2 und 3) voneinander abgegrenzten Hirnareale haben jeweils unterschiedliche Anforderungen hinsichtlich der Art und Weise der Neuronenvernetzung.
- Unterschiedliche Stufen der Degeneration in verschiedenen Hirnarealen möglich
Eine degenerative Entwicklung in einer bestimmten Hirnregion kann sich unabhängig von anderen Regionen entwickeln, so dass sich verschiedene Areale auf unterschiedlichen Niveaus befinden.
- Verlauf
Ein stetiger Verlauf von Stufe 1 zur Stufe 3 ist nicht zwingend, der Verlauf kann jederzeit zum Stillstand kommen. Eine Umkehrung (Remission) ist möglich. Eine degenerative Entwicklung kann auch auf Stufe 2 oder 3 beginnen. Durch einen massiven und schnellen Prozessverlauf kann der Eindruck entstehen, dass Stufen übersprungen werden.
- Wahrnehmung eingeschränkter Hirnleistungen
Betroffene können eine degenerative Entwicklung in Form von kognitiven oder emotionalen Einschränkungen bzw. Veränderungen wahrnehmen.
- Stufenmodell und entstehendes Nervensystem
Störungen der Zellfunktionalität, -vernetzung und ‑dichte können auch während der vorgeburtlichen Nervensystembildung auftreten.
ABBILDUNG 4: DAS 3-STUFEN-MODELL DYSFUNKTIONALER NERVEN- UND GLIAZELLEN
Abbildung 4: Zunächst sind alle Zellen und Zellfunktionen intakt, Neuronen und Gliazellen verfügen über eine angemessene, nach außen gerichtete Zellaktivität und eine ausreichende Anzahl von Zellen, wobei die Neuronen darüber hinaus untereinander ausreichend vernetzt sind (Stufe 0, links oben). In der ersten Stufe (rechts oben) verändern sich die Aktivitäten einzelner ‑ grau markierter ‑ Zellen, was sich in einer Reizübertragungs- und/oder Reizweiterleitungsstörung manifestiert. Die Verbindungen zu anderen Nervenzellen sind (noch) stabil. In Stufe 2 (links unten) werden die Verbindungen der Zellen untereinander nach und nach gekappt. In Stufe 3 (rechts unten) stirbt ein Teil der Zellen ab. Damit sind auch die restlichen Verbindungen zu anderen Zellen verloren gegangen, das System ist sichtbar reduziert.
1.5 Primäre Ursachen von Affektstörungen (Kausaltheorie) und erste Schlussfolgerungen ▲
Das 3-Stufen-Modell zeigt den degenerativen Verlauf eines Netzes von Nerven- und Gliazellen und bringt die Thesen 1 und 2 bildhaft zum Ausdruck, nach denen Affekterkrankungen aus komplexen Störungen von Nerven- und Gliazellen resultieren. Aus der Kombination von 3‑Stufen‑Modell und dem in These 3 beschriebenen Hirnfunktionsmodell folgt die Kausaltheorie:
Affekterkrankungen resultieren unmittelbar aus den im 3‑Stufen‑Modell dargestellten Funktions- bzw. Aktivitätsstörungen von Neuronen bzw. Gliazellen in einem oder
mehreren der nachfolgend aufgezählten Hirnareale bzw. ‑strukturen.
- Primär: Gyrus cinguli, Hippocampus, Fornix und Amygdala
- Sekundär: Basalganglien, Thalamus und Assoziationsareal des Cortex
- Tertiär: Hypothalamus-Hypophysen-Achse, Epiphyse und Mittelhirn
Da das aufsteigende, retikulär-aktivierende System (ARAS) der Formatio reticularis durch die meisten dieser Areale führt, ist die Involvierung dieser für die Entstehung und Verarbeitung von Emotionen wichtigen Hirnstruktur wahrscheinlich.
Die Strukturen des Parahippocampalis und der Mamillarkörper sind nicht eindeutig zuzuordnen.
Mit Hilfe dieses Postulats sind Aussagen über bestimmte Charakteristiken affektiver Erkrankungen, beispielsweise über psychosomatische Phänomene, Symptomvielfalt, Chronifizierung, Erkrankungsintensität oder Resilienz, möglich.
Psychosomatische Phänomene resultieren auch aus sich überschneidenden Funktionsbereichen
Gehirnlandkarte (→ Abbildung 2) und Funktionsmodell (→ Abbildung 3) legen eine Organisation des Zentralnervensystems in drei Funktionsbereiche nahe.
Der erste Funktionsbereich umfasst das bewusste Wahrnehmen, Handeln und die Persönlichkeit. Die dafür zuständigen Hirnareale befinden sich in der äußeren und inneren Großhirnrinde (Cortex).
Der zweite Funktionsbereich repräsentiert die autonom-unbewusste Körperfunktionensteuerung, Bewegungen und das Gedächtnis. Diese Funktionen sind in den Großhirnkernen unterhalb des Cortex, zu denen Basalganglien, Hippocampi und Fornix zählen, als auch im Zwischenhirn einschließlich Hypophyse und Epiphyse, im Stammhirn mit Mittelhirn und Medulla oblongata und im Kleinhirn mit Brücke lokalisiert.
Der dritte Funktionsbereich umfasst alles, was im weitesten Sinne mit der Steuerung von Affekten, Emotionen und Antrieb im Zusammenhang steht und wird oft auch als Limbisches System bezeichnet. Die betreffenden Hirnstrukturen sind vorwiegend in der Gehirnmitte lokalisiert. Der überwiegenden Zahl dieser Hirnstrukturen ist gemein, dass sie nicht ausschließlich Aufgaben des dritten Funktionsbereichs übernehmen. In Richtung des Cortex gibt es Schnittmengen mit dem Funktionsbereich 1 und in Richtung des verlängerten Marks gibt es Schnittmengen mit dem Funktionsbereich 2.
Diese Lokalisation der emotions- und affektverarbeitenden Strukturen in der Hirnmitte, die auch Aufgaben der anderen Funktionsbereiche übernehmen, sagt sehr viel aus über deren Zusammenspiel mit Bewusstsein und Körperfunktionensteuerung.
Die Existenz von Schnittmengenfunktionen macht es möglich, den dritten Funktionsbereich in drei Teilbereiche zu gliedern, so dass sich die Konsequenzen dieser Besonderheit leichter erschließen:
- Der obere erste Teilbereich, der eine Schnittmengenfunktion von Bewusstsein und Emotionalität erfüllt, ist für die bewusste Wahrnehmung von Emotionen und Antrieb verantwortlich. Zum ihm gehören Gyrus cinguli und das Assoziationsareal, ggf. kommt noch der Parahippocampus dazu.
Gyrus cinguli und Parahippocampus erhalten Reize der darunter liegenden affektverarbeitenden Areale, die auf diese Weise in das Bewusstsein vordringen und empfunden werden können. Ebenfalls werden Reize an das Assoziationsareal des äußeren Cortex weitergeleitet, um dort bewusst intellektualisiert und bewertet zu werden.
- Die Amygdala bildet den zweiten Teilbereich ohne Schnittmengenfunktion und ist als dessen einzige Struktur ausschließlich für die Emotions- und Angstverarbeitung zuständig. Sie übernimmt also keine Aufgaben der anderen beiden Funktionsbereiche.
Die Amygdala steht jedoch mit dem ersten und dritten Teilbereich in einer starken Verbindung. Sie erhält Reize von den darunter liegenden affektverarbeitenden Arealen und sendet Reize in Areale, die für die autonome Steuerung von Emotionalität und Körperfunktionen zuständig sind. Ebenfalls erhält und sendet sie Reize in Areale, die emotionales Erleben ermöglichen.
- Der untere dritte Teilbereich übernimmt wichtige Funktionen bei der autonomen Entstehung von Affekten, ohne dass diese bewusst werden, ist aber auch für Körper-, Bewegungs-, Lern- und Gedächtnisfunktionen zuständig. Das gilt für die Basalganglien, für die Hippocampi mit dem Fornix, für den Thalamus, Hypothalamus und die Hypophyse, für das Mittelhirn und die Epiphyse, ggf. auch die Mamillarkörper.
Vor allem die Tatsache, dass die Emotionsverarbeitung und die Steuerung körperlicher Funktionen in den selben Hirnarealen stattfinden, repräsentieren auf der Ebene des Zentralnervensystems das umgangssprachlich als Verbindung von Körper und Seele bezeichnete Phänomen. Hier werden Körperreaktionen auf den emotionalen Bereich übertragen und umgekehrt. Kommt es hier zu hirnorganischen Störungen, ist oft auch Beides betroffen.
Darüber hinaus sind die drei großen Hirnfunktionsbereiche durch übergeordnete Hirnstrukturen, beispielsweise die Formatio reticularis, miteinander verknüpft. Das schafft eine weitere Verbindung und ist auf der Ebene des Zentralnervensystems eine weitere Ursache für das, was als die Verbindung von Körper und Seele bezeichnet wird.
Die Verknüpfung körperlicher und emotionaler Funktionen in denselben oder eng benachbarten Arealen einschließlich der Verbindungen durch spezielle Hirnstrukturen sind eine wichtige Begründung psychosomatischer Phänomene.
Das impliziert, dass sich viele psychosomatische Phänomene kausal auch als Folge simpler organischer Störungen der Hirnbereiche erklären lassen, die sowohl für die Emotions- und Affektverarbeitung als auch für die Steuerung der Körperfunktionen zuständig sind. In einem solchen Fall muss kein komplizierter Zusammenhang zwischen Körper und Psyche konstruiert werden, die Ursache ist rein hirnorganisch.
Die Abbildungen 5a und 5b veranschaulichen die dreiteilige Strukturierung des Gehirns mit ihren jeweiligen räumlich‑funktionellen Überschneidungen bzw. Schnittmengen.
ABBILDUNGEN 5 A/B: DAS EMOTIONALE GEHIRN ALS BRÜCKE ZWISCHEN KÖRPER UND BEWUSSTSEIN
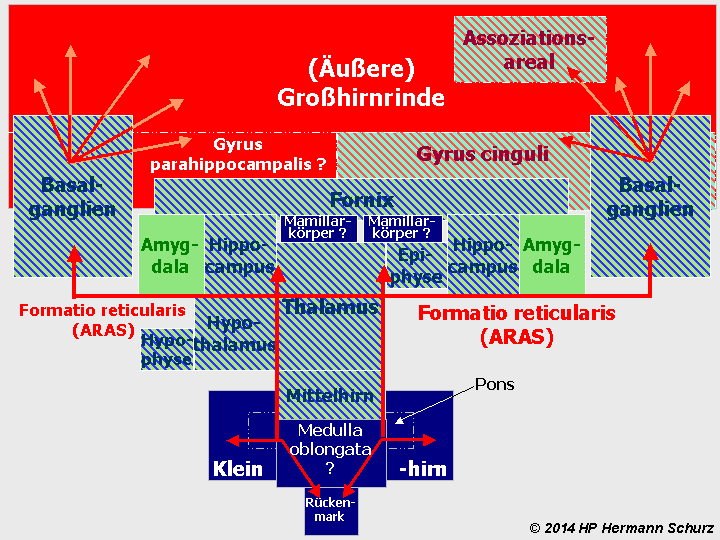
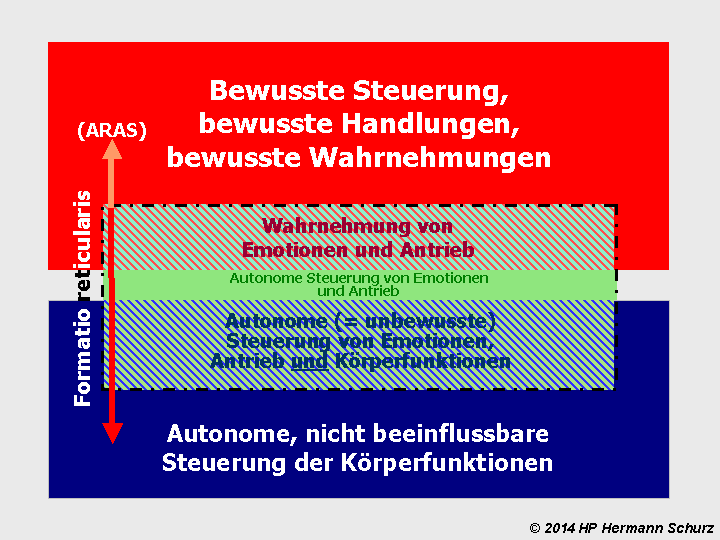
Abbildungen 5a und 5b: Der für Emotionen und Antrieb zuständige Hirnbereich (grün bzw. grün-schraffiert) befindet sich zwischen denen, die für das Bewusstsein bzw. die Persönlichkeit (rot) und die autonome Körperfunktionssteuerung (blau) zuständig sind, wobei einige Areale an den Grenzen Funktionen in beiden Bereichen ausüben. Die untere Abbildung 5b verdeutlicht die Zusammenhänge schematisch. Aus zahlreichen funktionellen Überschneidungen in denselben Hirnregionen ergeben sich Konsequenzen für das Zusammenspiel zwischen Körper und Psyche und begründen unter anderem den psychosomatischen Blickwinkel in der Medizin auf der Ebene des Zentralnervensystems (insbesondere die blau-grün-schraffierten Areale). Auch die Formatio reticularis spielt hier eine wichtige Rolle, da sie alle drei Bereiche zusätzlich miteinander verknüpft und dadurch auf der Ebene des Zentralnervensystems eine weitere Verbindung zwischen Körper und Psyche schafft.
Die oben dargestellten Zusammenhänge eignen sich auch dazu, das Phänomen einer larvierten Depression neurobiologisch zu erklären, bei der die Depression mit einer Fülle körperlicher Beschwerden einhergeht. Der Fachterminus beruht auf dem lateinischen Wort „larva“ für Maske. Eine synonyme Bezeichung ist daher die maskierte Depression, manchmal wird auch der Begriff der somatisierten Depression verwendet.
Leider werden die Zusammenhänge zwischen den körperlichen und psychischen Beschwerden häufig einseitig rein psychologisch gedeutet, was sich schon aus der unglücklichen Wahl des Maskenbegriffs ergibt. Das gipfelt dann in der Unterstellung, der Patient verstecke sich hinter körperlichen Beschwerden, die er sich nur ausdenke aufgrund der Unfähigkeit, seine psychischen Probleme zu erkennen und zu akzeptieren.
Sehr aufschlussreich in dieser Hinsicht ist ein Text über die larvierte Depression auf einem medizinischen Fachportal aus Österreich: „Bei vielen depressiven Patienten stehen unspezifische somatische Beschwerden im Vordergrund. «Diese Patienten klagen über Rückenschmerzen oder gastrointestinale Symptome, sprechen aber nicht über eine depressive Symptomatik. Aus ihrer Befindlichkeit und ihrem Verhalten ist auch nicht erschließbar, dass letztendlich eine Depression die Ursache dieser Symptome ist», erklärte Müller-Spahn das Konzept der larvierten Depression. (...) Laut einer epidemiologischen Untersuchung an der Psychiatrischen Klinik Basel leiden zwischen 5 und 10% der depressiven Patienten an einer larvierten Depression und etwa 50% der Hausärzte berichten, dass depressive Patienten mit einer solchen Symptomatik in der Praxis vorstellig werden. Gründe dafür sind einerseits, dass Betroffene nicht über Depression sprechen möchten, und andererseits, dass sie die zugrunde liegende Störung nicht erkennen. Das Konzept der larvierten Depression wurde in den 70er Jahren von dem Basler Psychiater Kielholz entwickelt. Dabei wurde auch versucht, ein Ranking der somatischen Symptome zu erstellen, an dessen erster Stelle die Schlafstörungen standen. Schlafstörungen bei Depressionen weisen ein charakteristisches Symptommuster mit frühmorgendlichem Erwachen, Zwangsgrübeln, massiver Hoffnungslosigkeit und erhöhtem Suizidrisiko in den frühen Morgenstunden auf. Dazu kommen Müdigkeit, Abgeschlagenheit, Obstipation und Gewichtsverlust. «Das sind scheinbar ganz unspezifische Symptome, die für sich genommen keine diagnostische Relevanz haben, aber einen Hinweis auf die Depression geben können, wenn keine somatischen Ursachen zu finden sind», erklärte Müller-Spahn. (...) Das Konzept, dass somatische Störungen eine Depression derartig überlagern können, dass die zugrunde liegende Erkrankung nicht mehr erkennbar ist, ist zumindest seit den 1920er Jahren bekannt. So hat bereits Bleuler den Begriff 'somatisierte Depression' geprägt, unter dem er eine endogene Depression verstand, bei der sich Patienten spontan nur mit somatischen Symptomen in der Sprechstunde präsentieren und deren depressiver Gemütszustand erst nach geeigneten Fragen offensichtlich wird. Im anglo-amerikanischen Sprachraum war von der 'physical form of depression', 'hidden depression' oder 'masked depression' die Rede, wobei letzterer Begriff sich zum weltweit am häufigsten verwendeten entwickelte. Weit verbreitet waren auch die Termini 'vegetative Depression' beziehungsweise 'vegetative Dystonie' als Sammelbegriffe für Phänomene erhöhter autonomer Reagibilität, diese jedoch nicht wirklich fassbar machten. Müller-Spahn: «Das Charmante am Konzept der larvierten Depression war, dass es eine klare therapeutische Konsequenz hatte. Hinter dieser vielgestaltigen Phänomenologie verbirgt sich eine Depression, die mit Antidepressiva zu behandeln ist.»“ (Quelle: Die larvierte Depression: wenn sich die Seele hinter dem Körper verbirgt, Webportal der Universimed Cross Media Content GmbH, Wien/Österreich, http://neurologie‑psychiatrie.universimed.com/...).
Es ist zweifellos wichtig, Schilderungen körperlicher Beschwerden zu hinterfragen, gerade wenn aus ärztlich-heilprakterischer Erfahrung derartige Symptome mit einer Affektstörung verbunden sein können. Daher kann man umgangssprachlich auch von einem „charmanten Konzept der larvierten Depression“ sprechen, obwohl die Verwendung des Begriffs „Konzept“ hier mehr als fragwürdig ist. Ist eine Erkrankung ein Konzept? Wohl kaum.
Es ist aber eindeutig zweifelhaft, eine Depression als Ursache dieser körperlichen Beschwerden zu deuten und sie darüber hinaus noch als Scheinsymptome aufzufassen, durch die „sich die Seele hinter dem Körper verbirgt“. Aber sowohl in der klinischen Psychologie als auch der Psychiatrie hat es ja noch nie an Versuchen gemangelt, sich die absurdesten Szenarien als Ursachen unverstandener Erkrankungen auszudenken.
So ist es eher wahrscheinlich und plaubsibel begründbar, dass zwischen der Depression und den körperlichen Symtomen eine Korrelation vorliegt, und die körperlichen sind genauso real wie die psychiatrischen Beschwerden. Denn beide resultieren primär aus den neurobiologischen Störungen von Hirnarealen, die sowohl für körperliche als auch für psychiatrische Beschwerden verantwortlich sind, was in den beiden Abbildungen 5a und 5b dargestellt ist.
Eine vergleichbare Sicht scheint sich auch in der Medizin langsam durchzusetzen, interessant ist hier ein Eintrag des Webportals doccheck.com zur Pathophysiologie der larvierten Depression: „In neurobiologischen Untersuchungen konnte der Nachweis erbracht werden, dass somatische Symptome mit Hirnfunktionsstörungen korrelieren, die auch für die Depression verantwortlich sind. So konnte in Untersuchungen gezeigt werden, dass psychischer und emotionaler Schmerz zu einer Aktivierung der gleichen Regionen wie physische Schmerzreize führen. Untersuchungen der Stressachse dokumentieren sowohl bei der Depression, als auch bei Schmerzen eine neuroendokrine Dysregulation der Hypothalamus-Hypophysen-Nebennieren-Achse mit Überproduktion des Corticotropin-freisetzenden Hormons CRH, was die Parallelität funktioneller Veränderungen physiologischer Parameter in der Depression und bei Schmerzzuständen belegt.“ (Quelle: Pathophysiologie der larvierten Depression, Webportal der DocCheck Medical Services GmbH, Köln, http://flexikon.doccheck.com/...).
Weitere Interpretationen hinsichtlich Symptomvielfalt, Chronifizierung und Erkrankungsintensität
Naheliegend ist, dass die vier verschiedenen Intensitäten (leicht, mittelgradig, schwer, schwerst) und die Symptomvielfalt der Erkrankung in unterschiedlichen Bereichen (Denken, Fühlen, Verhalten, Körper) aus den vielzahligen Kombinationsmöglichkeiten des 3-Stufen-Modells und der Betroffenheit 12 verschiedener Hirnareale und ‑strukturen resultieren.
Trivial ist eine Kausalbeziehung zwischen der Symptomanzahl und der Anzahl betroffener Hirnstrukturen. Durch die Verantwortlichkeit der Hirnstrukturen für jeweils bestimmte Funktionen besteht ein Zusammenhang zwischen der Anzahl an Symptomen und der Anzahl betroffener bzw. geschädigter Hirnstrukturen (Graphik 1).
Bei einer Hirnstruktur kann es sich auch um den Teilbereich eines der kausaltheoretisch begründeten Hirnareale handeln.
GRAPHIK 1: DIE KAUSALTHEORETISCHE BEGRÜNDUNG DER SYMPTOMVIELFALT
Graphik 1: Mit der Anzahl der involvierten Hirnareale oder kleinerer Hirnstrukturen steigt tendenziell auch die Anzahl wahrgenommener Symptome. Diese Aussage ist ein ausreichender Erkenntnisgewinn und soll nicht weiter differenziert werden, zum Beispiel hinsichtlich bestimmter Symptome. Denn dazu ist das derzeitige Verständnis der Areale und deren Verbindungen noch zu diffus. Auch der Begriff „involviert“ ist gerade aufgrund der unübersichtlichen Arealverschaltung weit auszulegen. So kann ein bestimmtes Symptom aus einem degenerativen Prozess innerhalb eines bestimmten Areals resultieren, das direkt für das Symptom verantwortlich ist. Es ist aber auch möglich, dass der Fehler an einer ganz anderen Stelle entsteht und aufgrund komplexer Verschaltungen oder einer Reizweiterleitung durch die Formatio reticularis an ein anderes Areal weitergeleitet wird und die Symptomatik dort entsteht.
Die Chronifizierungsgefahr steht tendenziell mit dem durchschnittlichen Zustand der Hirnareale in einem ursächlichen Zusammenhang. Das bedeutet: Je weiter rechts man sich auf der Skala des 3-Stufen-Modells befindet, desto höher ist die Wahrscheinlichkeit eines chronischen Verlaufs.
Es ist zu beachten, dass genauere Aussagen nur schwer zu machen sind, beispielsweise auf welche Hirnareale das mehr bzw. auf welche es vielleicht weniger zutrifft oder ob auch ein einziges erkranktes Hirnareal zu einer Chronifizierung führen kann.
Einschätzungen der Stufe 0 erfolgen an dieser Stelle noch nicht. Es ist davon auszugehen, dass auf Stufe 0 negative Einflüsse (Noxen) von außen einwirken, über die aber noch keine Aussagen gemacht werden können, denn in der Kausaltheorie wird die Umwelt ausgeblendet.
GRAPHIK 2: DIE KAUSALTHEORETISCHE BEGRÜNDUNG DER CHRONIFIZIERUNG
Graphik 2: Die tendenzielle Gefahr der Chronifizierung einer Affektstörung steigt von Stufe zu Stufe und ist bei Stufe 3 am höchsten. Genauere Aussagen sind an dieser Stelle noch nicht möglich.
Nicht ganz so einfach ist es, Erkrankungsintensitäten zu begründen. Die Erkrankungsintensität wird mittels vier Schweregraden (leicht, mittelgradig, schwer und schwerst) kategorisiert, welche idealerweise verschiedene Fähigkeiten zur Gestaltung des Tagesablaufs in der Depression beschreiben (→ Abschnitt 1.1).
Die vier Schweregrade sind zwar objektiv gut zu unterscheiden, denn man muss sich nur ansehen, wie Betroffene ihren Tagesablauf tatsächlich bewältigen. Dennoch stecken bei Personen, die sich augenscheinlich auf der gleichen Stufe befinden, nicht unbedingt die gleichen hirnorganischen Defizite oder der gleiche Leidensdruck dahinter. Es kann jedoch auch hier davon gesprochen werden, dass eine höhere Erkrankungsintensität tendenziell auch auf stärkeren hirnorganischen Dysfunktionen beruht ‑ und demnach weiter rechts auf einer Skala des 3‑Stufen‑Modells.
Ungünstige Veränderungen der Gehirnstruktur sind hinsichtlich ihrer Auswirkungen zwischen zwei Personen jedoch niemals vergleichbar, selbst wenn die Veränderungen objektiv messbar und als identisch eingeschätzt würden. Eine auf bestimmte Weise geschädigte Hirnregion verursacht bei dem einen neurologische Ausfälle oder psychiatrische Symptome, bei jemand anderem nichts dergleichen.
Graphik 3 zeigt die Zusammenhänge aus der Sicht verschiedener Personen.
GRAPHIK 3: DIE KAUSALTHEORETISCHE ERKLÄRUNG DER ERKRANKUNGSINTENSITÄTEN
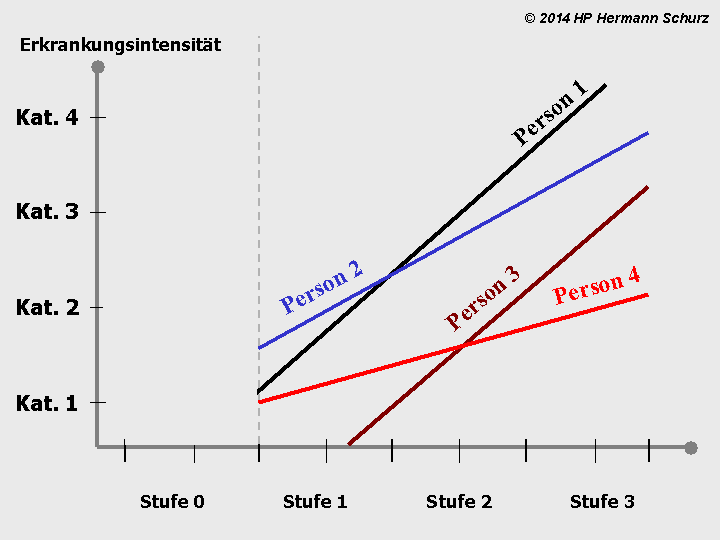
Graphik 3: Vier Kategorien stehen mit theoretisch messbaren hirnorganischen Veränderungen in einem stetig‑steigenden Zusammenhang, der jedoch relativ ist und sich von Individuum zu Individuum erheblich unterscheiden kann.
Erkrankungsintensität = Leidensdruck?
Eng verbunden mit der Frage nach den Gründen für verschiedene Erkrankungsintensitäten ist die Frage nach einer Definition des Begriffs „Leidensdruck“.
Absolute Vorsicht ist geboten bei der Verwendung dieses Wortes, denn seine sprachliche Bedeutung ist höchst schwammig. Natürlich ist es naheliegend anzunehmen, dass der Leidensdruck umso höher ist, je höher die zugeordnete Kategorie der Erkrankungsintensität ist. Eine Person, die das Bett nicht mehr verlassen kann, wird höchstwahrscheinlich einen höheren Leidensdruck verspüren als jemand, der seinen Tagesablauf noch einigermaßen organisiert.
Man sollte sich aber bewusst sein, dass eine solche simple Einschätzung voreilig ist. Denn vielleicht ist der tatsächlich empfundene subjektive Leidensdruck der Person, die ihren Tagesablauf noch organisieren kann, viel höher als derjenigen Person, die bettlägerig ist. Denn hier spielen persönliche Charaktermerkmale, zum Beispiel die Neigung zur Aggravation, familiärer bzw. gesellschaftlicher Druck oder bestimmte Phänomene, wie beispielsweise der sekundäre Krankheitsgewinn, eine erhebliche Rolle.
Auch erfahrene Therapeuten sind nicht davor gefeit, die tatsächliche Situation aus diesen Gründen fehleinzuschätzen, falsche Schlüsse zu ziehen und Patienten nicht adäquat zu behandeln. Auch Suizidgefahren werden durch Fehleinschätzungen häufig übersehen.
Eine Erklärung des Resilienz-Phänomens anhand der kausaltheoretischen Modelle
Es ist sehr in Mode, den Begriff der Resilienz zu verwenden. Aber was genau ist Resilienz und ist sie mit den bisher vorgestellten Modellen erklärbar?
Resilienz bedeutet Widerstandsfähigkeit. In der Psychologie definiert man Resilienz als die Fähigkeit, eine persönliche Krise bewältigen zu können, ja eventuell sogar gestärkt aus ihr herauszukommen.
Zwar sind Krisen als äußere Ereignisse in den bisher erarbeiteten Modellen noch nicht vorgesehen, es sind aber auch jetzt schon Aussagen über die kausaltheoretischen Hintergründe des Resilienz-Phänomens möglich.
Danach hängt die Widerstandsfähigkeit eines Menschen von zwei Einflüssen ab: 1. von der Anzahl der in einen degenerativen Prozess involvierten Hirnareale und 2. vom Zustand nach dem 3‑Stufen‑Modell, auf dem sich die Hirnareale im Durchschnitt befinden.
Diese Aussage gilt auch für Menschen, bei denen keine oder (noch) keine Affektstörung feststellbar ist, zum Beispiel wenn deren Hirnstatus trotz einer schon eingesetzten degenerativen Entwicklung (noch) keine psychiatrische Symptomatik als Folge hat.
Resilienz ist danach negativ von der Anzahl erkrankter Hirnareale abhängig. Das gilt auch für den Status nach dem 3‑Stufen‑Modell, auf dem sich das Individuum durchschnittlich befindet. Das bedeutet auch: Resilienz kann sich im Laufe der Zeit verändern.
Im Einzelnen ist Resilienz folgendermaßen charakterisiert:
- Die Resilienz bzw. Widerstandskraft ist tendenziell niedrig bei einer eher hohen Anzahl der in einen degenerativen Prozess involvierten Hirnstrukturen bzw. -areale nach dem Hirnfunktionsmodell (→ Abbildung 3), als auch bei einem eher fortgeschrittenen degenerativen Status nach dem 3-Stufen-Modell (→ Abbildung 4).
- Die Resilienz bzw. Widerstandskraft ist tendenziell hoch bei einer eher niedrigen Anzahl der in einen degenerativen Prozess involvierten Hirnstrukturen bzw. -areale nach dem Hirnfunktionsmodell (→ Abbildung 3), als auch bei einem eher gering fortgeschrittenen degenerativen Status nach dem 3-Stufen-Modell (→ Abbildung 4).
- Unterstellt man einen eher fortschreitenden Degenerationsprozess, sinkt die Resilienz eines Individuums tendenziell im Laufe der Zeit. Es ist aber auch die umgekehrte Situation möglich.
Zu den beiden Einflüssen gesellt sich allerdings noch mindestens eine weitere Einflussgröße, die hier generell keine Rolle spielt: die Persönlichkeit. Es ist also auf keinen Fall so, dass nur kausaltheoretisch begründbare Einflussfaktoren bei der Resilienz eines Menschen ausschlaggebend sind.
Leider werden im Zusammenhang mit der Beschreibung von Persönlichkeitsmerkmalen häufig sehr schwammige Begrifflichkeiten verwendet. So spricht man allgemein von einer „starken“ bzw. „schwachen“ Persönlichkeit. Eine hohe Resilienzeigenschaft wird dementsprechend eher bei einer „starken“ Persönlichkeit vermutet als bei einer „schwachen“.
Die Frage ist nur, was beide Persönlichkeitstypen hirnorganisch voneinander unterscheidet. Die Erkenntnisse der Hirnforschung lehren, dass die Ausprägungen der Persönlichkeitsmerkmale im präfrontalen Cortex lokalisiert sind. Bei Anwendung kausaltheoretischer Erkenntnisse auf diesen Bereich kommt man zu dem Schluss, dass individuelle Persönlichkeitsmerkmale wiederum vom individuellen neurologischen Zustand des präfrontalen Cortex abhängig sein müssten.
Demnach könnte man auch hier das 3‑Stufen‑Modell nutzen und postulieren, dass der präfrontale Cortex einer starken Persönlichkeit mit der richtigen Anzahl gut funktionierender Neuronen (einschließlich Gliazellen) ausgestattet ist, die darüber hinaus noch auf eine besondere Art dicht vernetzt sind. Bei einer weniger starken Persönlichkeit wären Funktionsfähigkeit und/oder Vernetzung und/oder Anzahl der Nervenzellen (und Gliazellen) in dieser Hirnregion dagegen suboptimal.
Die Abgrenzung depressiver Verstimmungen von der Depression
Depressive Verstimmungen, beispielsweise aufgrund von Lebenskrisen oder vor schwierigen Entscheidungen, sind aus kausaltheoretischer Sicht keine klinisch relevante Erkrankung. Bei einer depressiven Verstimmung handelt es sich um eine normale Reaktion auf negative Ereignisse. Sie stellt damit eine externe Noxe dar, also einen negativen Einfluss aus der Umwelt.
Das schließt nicht aus, dass eine lang anhaltende und/oder sehr heftige depressive Verstimmung als Stressquelle zur Entstehung einer „echten“ (= klinisch relevanten) Depression beitragen kann. Zusammenhänge zwischen psychischem Stress und Affektstörungen werden im Rahmen einer multikausalen Theorie im vierten Kapitel noch erörtert.
Was verursacht den in der Kausaltheorie beschriebenen Verlauf?
Die Kausaltheorie erfüllt aufgrund nur drei zugrunde liegender Thesen die Anforderungen des wissenschaftlichen Sparsamkeitsprinzips (auch als „Ockhamsches Rasiermesser-Prinzip“ bezeichnet), nach der die Wahrscheinlichkeit des Zutreffens einer Theorie mit ihrer Einfachheit steigt unter der Voraussetzung, dass diese Einfachheit nicht unangemessen gesteigert wird: So wenig wie möglich und so viel wie nötig. Die Gründe für Einfachheit und Beschränkung und eine plausible Erklärung liegen auch im Bedürfnis nach Anwendung dieses Prinzips.
Die Theorie erhebt ebenfalls den Anspruch, eine allgemeingültige Erklärung unmittelbarer (= primärer) Erkrankungsursachen auf der Organebene zu sein und auch aus diesem Grunde muss sie sich zwingend auf eine einfache Zustandsbeschreibung beschränken.
Als potentielle Auslöser der im 3‑Stufen‑Modell beschriebenen Entwicklung kommen jedoch zahlreiche, völlig unterschiedliche Stressoren bzw. Noxen in Frage. Deren Ursache-Wirkungs-Beziehungen und Erklärungsmodelle müssen separat von der Kausaltheorie in einem zweiten Schritt analysiert werden.
Diese weitere Kausalebene betrifft alles, was vor dem Beginn der dreistufigen Entwicklung passiert, denn hier muss dieses Wechselspiel von Ursache und Wirkung beginnen. Und genau an dieser Stelle wird es eigentlich interessant, wenn man sich nicht mit der funktionalen Beschreibung von Zuständen auf der Organebene zufrieden geben will. Das 3-Stufen-Modell steht am Ende einer verhängnisvollen und folgenschweren Entwicklungskette.
Die Kausaltheorie sagt dennoch etwas über die Reizverarbeitungsqualität der Neuronen vor dem Beginn des degenerativen Verlaufs auf einer „Stufe 0“ aus: Die Verarbeitungsqualität ist hier noch tadellos. Mit dem Übergang zur Stufe 1 verschlechtert sich sich jedoch, irgend etwas muss diese ungünstige Entwicklung auslösen.
Es liegt die Vermutung nahe - und diese wurde weiter oben auch schon geäußert - dass diese Entwicklung im Inneren der Zellen beginnt. Ebenfalls sind mit hoher Wahrscheinlichkeit exogene, das heißt von außen auf die Zellen einwirkende Stressoren bzw. Noxen möglicherweise verantwortlich, wobei diese Noxen natürlich auch nichts anderes bewirken, als etwas im Zellinneren durcheinander zu bringen. Ebenfalls ist ein Mix von autonomen inneren und exogenen Ursachen möglich.
Identifikation und Kausalanalyse potentieller endogener und exogener Stressoren stehen von nun an im Vordergrund.
1.6 Verifikationen der Kausaltheorie durch den Nachweis funktionaler und degenerativer Hirnveränderungen ▲
Zunächst soll jedoch die Frage beantwortet werden, ob Aussagen der Kausaltheorie über degenerative Hirnstrukturveränderungen mit Hilfe moderner Untersuchungsmethoden überprüfbar sind und bestätigt werden können.
Die konservative medizinisch-psychiatrische Forschung scheint seit einigen Jahren etwas aus ihrem Dämmerschlaf zu erwachen. Es werden erste Studien erstellt, die einen Zusammenhang zwischen einer Depression und funktionalen bzw. strukturellen Hirnveränderungen aufspüren sollen. Die in Verdacht stehenden Hirnareale, von denen fast alle auch in der Kausaltheorie postuliert sind, werden mit Hilfe von PET‑, fMRT- und MRT‑Technologien untersucht, letztere gibt es immerhin schon seit dem Jahre 1973. Es sind insbesondere die Strukturen des linken und rechten Hippocampus, des Mandelkerns, der Basalganglien, bestimmter Cortex-Regionen und des Zwischenhirns, um die sich die Forschung bemüht.
Diese Untersuchungsmethoden sind grundsätzlich geeignet, die Kausaltheorie mit dem 3‑Stufen‑Modell und dem Funktionsmodell zu verifizieren. Dabei sind deren Untersuchungsungenauigkeiten zu berücksichtigen. Man muss davon ausgehen, dass nur sehr starke Strukturveränderungen mit der MRT messbar sind und bisher kaum Langzeituntersuchungen vorliegen. Die fMRT reagiert auf Durchblutungsveränderungen, so dass die Ergebnisse die neuronale Aktivität indirekt abbilden. Dasselbe gilt für die PET, die den Abbau von Glukose in den jeweiligen Hirnarealen sichtbar macht. Daraus folgt, dass nicht alle Struktur- und Funktionalveränderungen mit den Methoden eindeutig erfassbar sind.
Ebenso ist es möglich, dass Nervenzellen bei Hirnstrukturerkrankungen durch Gliastützzellen ersetzt werden, die für die Reizverarbeitung keine Rolle spielen. Solche Strukturveränderungen sind mit einer MRT aber überhaupt nicht erkennbar und erst im Rahmen einer Gewebeuntersuchtung nach dem Tode feststellbar.
Umso bemerkenswerter und aussagekräftiger ist es, wenn strukturelle oder funktionelle Veränderungen bei affektiv erkrankten Personen nachweisbar sind und sowohl das 3‑Stufen‑Modell als auch das Funktionsmodell stützen.
Die Studien von Sheline et al. an depressiven Patienten aus den Jahren 1996 bis 1999 und weitere Studien stellen signifikante Volumenminderungen des linken und rechten Hippocampus fest. Mehrere Studien weisen Atrophien des frontalen und präfrontalen Cortex nach, ebenso Volumenminderungen im Gyrus cinguli.
Untersuchungen der Amygdala lieferten unterschiedliche Resultate. Sie reichen von Volumenzunahme (Weniger et al. 2006 bzw. Frodl et al. 2002) oder Volumenabnahme (Sheline et al. 1998 bzw. Strakowski 2002) bis zu Veränderungen der Symmetrie.
Interessant ist hier die Volumenzunahme. Eine solche ist auf den ersten Blick im 3‑Stufen‑Modell zwar nicht vorgesehen, steht damit aber auch nicht im Widerspruch. Derartige Veränderungen werden im Zusammenhang mit einer Affektstörung selten festgestellt. Es könnte sich dabei um ein relativ kurzfristiges Phänomen handeln, bei der sich die Amygdala bzw. ein anderes relevantes Hirnareal zunächst aufgrund negativer Einflüsse vergrößert, um dann später relativ stärker zu schrumpfen. Vielleicht sind auch Situationen denkbar, bei denen eine Volumenzunahme ähnliche Auswirkungen hat wie eine Volumenabnahme. Solche Reaktionen müssen im Modell nicht berücksichtigt werden, denn sie ändern nichts Grundsätzliches.
Eine über drei Jahre angelegte Dissertationsstudie der LMU München ergab, dass „(...) sich bezüglich des Amygdala-Volumens zeigte, dass Patienten mit rezidivierenden depressiven Episoden dann symptomfrei blieben, wenn sie ein signifikant größeres Amygdala-Volumen besaßen als Patienten, die sich in einem nicht-remittierten Zustand befanden. (...) Das Alter korrelierte mit einem erniedrigten Volumen der rechten und linken Amygdala.“ Auf jeden Fall konnte „kein signifikant größeres Amygdala-Volumen bei depressiven Patienten verglichen mit gesunden Probanden festgestellt werden.“ (Quelle: Palladino 2009).
Ebenfalls sind Volumenminderungen der Basalganglien im Zusammenhang mit depressiv Erkrankten nachgewiesen worden (Krishnan et al. 1992).
Eine Untersuchung aus dem Jahr 2004 analysierte 12 Studien, die eine Reduzierung der Hippocampi-Volumina mit unterschiedlichen Intensitäten bestätigten, die sich in ihren Voraussetzungen (Alter, Geschlecht, Krankheitsbeginn und -verlauf) stark unterschieden. Die Metastudie ergab, dass die Hippocampi der von einer unipolaren Depression Betroffenen im Schnitt eine Volumenminderung von 8% auf der linken und 10% auf der rechten Seite aufwiesen. Darüber hinaus ergaben die Auswertungen eine positive Korrelation der Volumenminderungen des rechten Hippocampus mit der Anzahl der depressiven Phasen (Quelle: Videbech/Ravnkilde 2004).
Sogar globale Volumenminderungen des Gehirns sind nachweisbar, wenn auch nicht mit einer großen Signifikanz, wie eine andere an der LMU München durchgeführte Dissertationsstudie herausfand. Für die Gruppe von Patienten mit einer Major Depression „(...) konnte eine leicht erhöhte (...) und in der Varianz verbreiterte globale Atrophierate nachgewiesen werden (...)“. Weiter heißt es: „Es ergaben sich Hinweise, dass bipolare Patienten sowie Patienten mit schweren Verläufen, gemessen an Suizidalität und psychotischem Erleben, möglicherweise erhöhte globale oder temporomesiale Atrophieraten aufweisen. Ob diese Veränderungen im Rahmen schwerer Episoden mit protrahierter Stresshormon-Dysregulation auftreten oder ob vorher oder parallel ablaufende Umbauvorgänge diese Krankheitsverläufe begünstigen, sollte durch prospektive Studien untersucht werden.“ (Quelle: E. Golgor 2009).
Interessant sind die PET- und fMRT-Technologien mit ihrem Nachweis funktioneller Veränderungen im Hirnstoffwechsel, da sie neben der These über die Beteiligung bestimmter Gehirnregionen ebenfalls die Aussagen über die ersten beiden Stufen des 3‑Stufen‑Modells stützen.
Studien der Universitätsklinik für Psychiatrie und Psychotherapie in Wien, die u. a. mit Hilfe der PET-Technologie durchgeführt wurden, stellten generell Veränderungen im präfrontalen Cortex und im emotionalen System fest (Quelle: CliniCum, Mag. Silvia Hecher 2009, www.clinicum.at):
- Erhöhte Aktivitäten in verschiedenen Bereichen des präfrontalen Cortex,
- verminderte Aktivitäten im dorsolateralen präfrontalen Cortex, wobei der Grad der Hypoaktivität mit dem Grad der Erkrankung korreliert,
- erhöhte Aktivitäten in der Amygdala und
- Dysfunktionen in den Hippocampi.
Unterstützt werden die kausaltheoretischen Aussagen ebenfalls durch die Ergebnisse der Wiener Wissenschaftler bei der Beobachtung des Krankheitsverlaufs. So stellten sie fest, dass die Hippocampi bei anhaltender Erkrankung immer mehr an Größe verlieren. Die Entdeckung steht im Einklang mit der unterstellten zeitlichen Abfolge beim 3‑Stufen‑Modell, denn dort kommt es in letzter Konsequenz auf Stufe 3 zu einem Abbau von Neuronen und Gliazellen, der sich bei andauernder Erkrankung weiter fortsetzt.
Ebenfalls ergaben die Analysen, dass die Wahrscheinlichkeit eines Verschwindens der Symptome (Remission) mit zunehmender Größe der Hippocampi steigt. Letztere Erkenntnis wird in der Diskussion über geeignete Therapien bei der Depressionsbehandlung im zweiten Teil der Ausführungen noch eine Rolle spielen.
Auch degenerative Veränderungen von Gliazellen geraten in der letzten Zeit in Zusammenhang mit der Ursachenforschung erfreulicherweise in den Fokus der Psychiatrie.
Untersuchungen an Verstorbenen haben gezeigt, dass die Gliazellendichte bei depressiv Erkrankten wesentlich reduziert ist. In einer anderen Untersuchung wurde ein signifikanter statistischer Zusammenhang zwischen der abnehmenden Dichte von Mikroglia und Fällen von vollzogenen Selbstmorden festgestellt (Quelle: F.A.Z. vom 3.12.2009).
In ihrer Dissertation aus dem Jahre 2002 beschreibt die Psychologin Jennifer Uekermann verschiedene neuropathologische Veränderungen bei einer unipolaren Depression, der hier zum Abschluss noch zitiert werden sollen. Die Autorin bezieht sich auf verschiedene Untersuchungen, die weitere interessante Belege für die vermuteten Kausalzusammenhänge zwischen funktionalen und strukturellen Hirnveränderungen und einer Affektstörung sind: „Um die Frage nach Dysfunktionen umschriebener Hirngebiete bei depressiven Erkrankungen zu untersuchen, wurden in den letzten Jahren Studien mithilfe von EEG- und bildgebenden Verfahren wie der Positronenemissionstomographie durchgeführt (vgl. Uekermann & Daum, 2000). Dabei fanden sich übereinstimmend Funktionsstörungen im Frontalhirn der linken Hemisphäre. Auch Analysen des Spontan-EEGs zeigten bei Depressiven eine verminderte linksfrontale Aktivierung. Für eine Funktionsstörung der linken Hemisphäre spricht ebenso die Tatsache, dass depressive Symptome weit häufiger nach links- als nach rechtshemisphärischer Läsion auftreten (Robinson et al., 1984). In den letzten Jahren ist in verschiedenen morphometrischen Studien ein vermindertes Volumen des frontalen Kortex (Drevets et al., 1997), des Nucleus caudatus (Krishnan et al., 1992), Putamen (Husain et al., 1991), der Hypophyse (Axelson et al., 1992), des Hippocampus (Bremner et al., 2000) und der Amygdala (Sheline et al., 1998) festgestellt worden. In Post-mortem-Studien wurde außerdem ein reduziertes Volumen des orbitofrontalen und dorsolateralen präfrontalen Kortex gefunden (Rajkowska et al., 1999; Ongur et al., 1998; Rajkowska, 2000; Sheline, 2000). Aktivierungsstudien zeigen einen reduzierten Blutfluss und eine verminderte Stoffwechselaktivität im medialen frontalen und im lateralen präfrontalen Kortex, im Zingulum und im Nucleus caudatus (Baxter et al., 1989; Baxter et al., 1985; Dolan et al., 1992; Bench et al., 1992; Cummings et al., 1993a; Devinsky et al., 1995). Dabei geht eine Verbesserung der klinischen Symptomatik mit einer Aktivierungszunahme in einigen betroffenen Regionen einher (Bench et al., 1995), während die Abnormalitäten im orbitalen und medialen präfrontalen Kortex bestehen bleiben (Drevets, 2000). Setzt man die gefundenen Aktivierungsminderungen mit kognitiven Variablen in Beziehung, bestätigt sich der Befund, dass vor allem der präfrontale Kortex eine wichtige Rolle für kognitive Funktionen bei Depressionen spielt (Dolan et al., 1994). Dafür spricht auch die Untersuchung von Bench et al. (1993), die über eine negative Korrelation zwischen der Stärke der Depression und dem regionalen Blutfluss im linken dorsolateralen präfrontalen Kortex und eine positive Korrelation zwischen kognitiven Leistungen und dem Blutfluss im linken frontalen medialen Kortex berichtete. Außerdem führt eine medikamentöse, antidepressive Therapie zu einer Erhöhung des Blutflusses im Frontallappen und Gyrus Cinguli (Buchsbaum et al., 1997). Die Minderaktivierung des medialen präfrontalen Kortex ist bei Depressiven u. a. deshalb von Bedeutung, da diese Region einen Teil des Belohnungssystems darstellt. Über einen verminderten Blutfluss in posterioren Arealen der linken Hemisphäre im Bereich des Gyrus angularis wurde ebenfalls berichtet, doch diese Aktivierungsminderung änderte sich nicht in Abhängigkeit von der Besserung der klinischen Symptomatik (Bench et al., 1995). Von besonderer Bedeutung für die neuropathologischen Veränderungen im Rahmen depressiver Erkrankung ist die Glukokortikoid-Hypothese. Dabei wird angenommen, dass die stressbedingte Ausschüttung von Cortisol zu einer Schädigung hippocampaler Neurone und einer nachfolgenden Hippocampus-Atrophie führen kann (Duman et al., 2000; Fujita et al., 2000; Sapolsky, 1992; vgl. Daum & Suchan, 2001).“ (Quelle: Jennifer Uekermann, Kognitive Veränderungen bei Alkoholismus und Depression, Inaugural-Dissertation, Fakultät für Psychologie der Ruhr-Universität Bochum, Bochum 2002, https://api.deutsche‑digitale‑bibliothek.de/binary/...).
1.7 Das 3-Stufen-Modell im Detail und erste Ursachenhypothesen ▲
Da in der Kausaltheorie nichts über endogene oder exogene Ursachen der verschiedenen Aktivitätsstörungen postuliert wird, müssen diese jetzt Schritt für Schritt identifiziert werden. Der erste Schritt besteht in der Ermittlung endogener Schwachstellen von Nerven- oder Gliazellen.
Bei dieser Analyse spielen Einflüsse von außen (noch) keine Rolle. In einem späteren Schritt, nachdem die Schwachstellen benannt werden können, wird untersucht, ob und auf welche Weise exogene Einflüsse diese Schwachstellen für ihre destruktive Wirkung auf das Nervensystem ausnutzen.
Die Zellpathologielehre als Basis
Biologie und Medizin beruhen wesentlich auf Erkenntnissen über die Zelle als Einheit des Lebens, die in der Mitte des 19. Jahrhunderts von den Berliner Ärzten Robert Remak und Rudolf Virchow gewonnen wurden. Seitdem hat sich die Zelltheorie rasant entwickelt, aber ihre Grundaussagen haben bis heute Bestand. Schon damals wurde erkannt, dass alle Leistungen eines Organismus und seiner verschiedenen Organe auf den Leistungen der Zellen und ihrer Zusammenarbeit beruhen. Virchow legte im Jahre 1858 mit der Veröffentlichung seiner „Cellularpathologie“ die Grundlagen der Zellpathologielehre, wonach Krankheiten auf Zellstörungen beruhen.
Schon das 3‑Stufen‑Modell und die dort beschriebenen Reizverarbeitungsprobleme ‑ und damit die Kausaltheorie insgesamt ‑ basieren auf diesen Grundannahmen. Was liegt daher näher, dafür Fehlabläufe im Zellinnern verantwortlich zu machen und eine weitere These zu formulieren?
These 4 markiert den Übergang von der Kausaltheorie zu einer umfassenderen, multikausalen Sicht:
- 4. These: Der im 3‑Stufen‑Modell beschriebene funktionale und strukturelle degenerative Verlauf eines Verbunds von Nerven- und Gliazellen beruht auf autonomen inneren ‑ d. h. endogenen ‑ Zellprozessstörungen.
1.7.1 Das 3-Stufen-Modell im Detail
Diese kurze These ist nun genauer zu differenzieren. Es müssen Zellaktivitäts- bzw. Reizverarbeitungsstörungen auf allen drei Modellstufen exakter beschrieben werden, als das im Abschnitt 1.4 gemacht wurde, um anschließend erste Vermutungen über die dahinter steckenden inneren Zellprozessstörungen anstellen zu können.
Einige wichtige Hinweise zur Terminologie und zum Verständnis:
Die Begriffe „Funktion(en)“ oder „Aktivität(en)“ werden hier ausschließlich im Zusammenhang mit den Aufgaben der Zellen ‑ also der Reizverarbeitung ‑ verwendet. Reizverarbeitung bedeutet im Kern Reizentstehung, Reizweiterleitung oder Reizübertragung und im weiteren Sinne die dazugehörigen Vernetzungsaktivitäten oder das Sorgen für eine bedarfsgerechte Zelldichte. Für die Reizverarbeitung wichtig sind auch die mittelbaren Aktivitäten verschiedener Gliazelltypen, zum Beispiel die Myelinisierung der Axone, die Ausführung von Immunfunktionen oder die Modulation der Reizübertragung. Funktionen oder Aktivitäten sie sind von der Zelle aus gesehen immer nach außen gerichtet.
Im Gegensatz wird bei inneren Zellvorgängen immer der Begriff Prozess bzw. Prozesse verwendet, auch in Wortverbindungen, beispielsweise Stoffwechselprozesse.
Natürlich ist es so, dass Funktionen bzw. Aktivitäten letztlich auf Zellprozessen beruhen und das ist ja auch die Basis der Kernaussage der These 4.
Die Begriffe Funktion(en)/Aktivität(en) auf der einen und Prozess/Prozesse auf der anderen Seite sollten jedoch nicht verwechselt oder als synonym betrachtet werden, da es sonst mit Sicherheit zu Missverständnissen kommt.
Vorstufe bzw. Stufe 0 und der Beginn latenter Prozessstörungen
Nerven- und Gliazellen erfüllen ihre Funktionen korrekt. Die Reizverarbeitung ist im Gleichgewicht. Das bedeutet: Jede Nervenzelle hat eine geregelte und intakte Reizentstehung, ‑weiterleitung und ‑übertragung.
Die Nervenzellen sind ausreichend vernetzt und können die Netzstruktur bei Bedarf verändern oder den Status quo beibehalten. Ebenfalls weisen alle relevanten Hirnregionen eine ausreichende Anzahl von Zellen auf. Das Gehirn ist in bestimmten Fällen in der Lage, bei Bedarf auch zusätzliche Zellen zu bilden oder für Ersatz zu sorgen (Neuroplastizität und Neurogenese).
Daraus ist zu schlussfolgern: Auf Stufe 0 sind auch die Stoffwechselprozesse im Zellinneren ausgeglichen.
Der Beginn ungünstiger Stoffwechselprozessveränderungen ist möglich, ohne dass zunächst Auswirkungen auf die Zellfunktionalitäten spürbar sind. Reizverarbeitung, Vernetzung und Zellenanzahl sind noch unauffällig, während im inneren der Zellen schon ein latenter Beginn degenerativer Veränderungen eingesetzt hat.
Stufe 1
Funktionsverschlechterungen von Nerven- oder Gliazellen bedeuten eine pathologische Reizverarbeitung. Die Hirnzellen agieren nicht in der notwendigen und gewünschten Weise.
Die Reizverarbeitungsstörungen müssen nicht zwangsläufig mess- oder darstellbar sein, denn das hängt von der Sensibilität der Mess- bzw. Aufnahmemethode ab. Die heute verfügbaren Verfahren (EEG, fMRT oder PET) sind noch immer relativ grob, und nur starke Veränderungen sind nachweisbar. Auch wenn eine Untersuchung keinen Verdacht auf strukturelle oder funktionelle Veränderungen ergibt, ist daraus nicht automatisch zu schließen, dass es in der Realität auch so ist.
Die Reizverarbeitungsprobleme treten entweder als unerwünschte Aktivitätsminderung oder als unerwünschte Aktivitätssteigerung auf. Nerven- und Gliazellen sind auf verschiedene Weisen in das Geschehen involviert.
- Nervenzellen:
Neuronen sind für Reizverarbeitungsstörungen direkt verantwortlich. Im Gegensatz dazu sind durch dysfunktionale Gliazellen bedingte Reizverarbeitungsstörungen mittelbar, denn sie unterstützen die Neuronen bei ihrer Tätigkeit, ohne Reize direkt zu verarbeiten.
Im Falle der pathologischen Reduktion von Reizverarbeitungsaktivitäten werden von Neuronen...
– zu wenig oder keine Reize gebildet,
– zu wenig oder keine Reize weitergeleitet und/oder übertragen,
– Reize mit einer zu geringen Impulsstärke (= zu niedrige Aktionspotentialfrequenz) weitergeleitet oder übertragen oder
– Reize mit einer zu geringen Geschwindigkeit weitergeleitet (reduzierte Nervenleitgeschwindigkeit).
Im Falle der pathologischen Steigerung der Reizverarbeitungsaktivitäten besteht der umgekehrte Sachverhalt. So werden...
– übermäßig viele Reize gebildet,
– übermäßig viele Reize weitergeleitet und/oder übertragen,
– Nervenimpulse mit einer zu hohen Impulsstärke (= zu hohe Aktionspotentialfrequenz) übertragen und/oder weitergeleitet oder
– Nervenimpulse mit einer zu hohen Nervenleitgeschwindigkeit weitergeleitet.
Die Kombination verschiedener Funktionsstörungen in einer Zelle ist möglich.
- Gliazellen:
Gliazellen sind mittelbar an der Reizverarbeitung beteiligt, deshalb haben dysfunktionale Gliazellen mittelbare Störungen der Reizverarbeitung zur Folge. Daraus ist jedoch nicht der Schluss zu ziehen, fehlerhaft arbeitende Gliazellen richten weniger Schaden an.
In der Regel mindern dysfunktionale Gliazellen ihre Aktivitäten. Ihre Aufgaben, Nervenzellen zu isolieren, zu stützen, zu modulieren und zu ver- bzw. entsorgen erfüllen sie nicht mehr ausreichend. So kommt es zum Beispiel bei einem zunehmend degenerativen Verlauf der Stufe 1 von myelinbildenden Gliazellen zu einer immer dünneren und damit immer schlechteren Isolierung der Nervenbahnen mit negativen Folgen für die Reizweiterleitung. Die Multiple Sklerose ist ein typisches Beispiel für eine Aktivitätsminderung der Gliazellen, es handelt sich um eine Entmarkungserkrankung des Gehirns. Die aus Oligodendrozyten bestehende Myelinschicht (Markscheide) geht an vielen (= multiplen) Stellen zugrunde.
Pathologische Steigerungen der Gliazellenaktivität sind selten, aber nicht ausgeschlossen. Beim Charcot‑Marie‑Tooth‑Hoffmann‑Syndrom, einer genetisch bedingten neuromuskulären Erkrankung des peripheren Nervensystems, kommt es aufgrund einer übermäßigen Myelinisierung der Schwann'schen Gliazellen zu verdickten Myelinscheiden. Infolgedessen sinkt die Nervenleitgeschwindigkeit mit der Folge einer Muskelatrophie, da die Signale des Gehirns die Muskulatur nicht mehr ausreichend erreichen und diese sich zurückbildet.
Bei Astrozyten, eine besondere Form der Gliazellen (→ Abschnitt 1.2), sind ‑ neben reduzierten ‑ ebenfalls übermäßige Aktivitäten denkbar.
Nun ist die Aufmerksamkeit auf dafür potentiell verantwortliche Fehlprozesse im Zellinneren zu richten.
Da es nur zwei Kategorien von Zellaktivitätsstörungen gibt, nämlich 1. die pathologisch verminderte bzw. 2. die pathologisch gesteigerte Reizverarbeitung, werden bei der Systematisierung der sie verursachenden inneren Zellprozessstörungen ebenfalls nur zwei Kategorien unterschieden, nämlich...
- endogene Störungen in Nerven- oder Gliazellen, welche die Reizverarbeitungsaktivitäten der Hirnzellen atypisch vermindern und
- endogene Störungen in Nerven- oder Gliazellen, welche die Reizverarbeitungsaktivitäten der Hirnzellen atypisch verstärken.
Es sind hier nicht ausschließlich mit der Reizverarbeitung verbundene Zellprozesse gemeint. Störungen betreffen auch Stoffwechselvorgänge, die nur indirekt mit der Informationsverarbeitung in Verbindung stehen, zum Beispiel Energieversorgungsprozesse oder die Bildung sonstiger Zellbestandteile, beispielsweise Membranen. Denn alle Abläufe im Zellinneren haben Auswirkungen auf die Reizverarbeitung.
An dieser Stelle muss man sich noch keine Gedanken darüber machen, was einen aktivierenden oder hemmenden Prozess charakterisiert. Ob sich um einen anabolen, katabolen oder wie auch immer gearteten Prozess handelt, ist bedeutungslos. So kann jeder pathologische Stoffwechselprozess eine anormale Reduzierung aber auch eine anormale Erhöhung der Reizverarbeitungsaktivitäten zur Folge haben.
Nun werden den beiden Typen von Reizverarbeitungsstörungen die dafür verantwortlichen inneren Zellprozessstörungen zugeordnet.
- Endogene Stoffwechselprozessstörungen, die zur pathologischen Reduktion von Reizverarbeitungsaktivitäten führen
Eine anormale Verringerung der Reizentstehungs-, Reizweiterleitungs- und Reizübertragungsaktivitäten resultiert daraus, dass...
- notwendige aktivierende (= exzitatorische) Stoffwechselprozesse in den Nervenzellen zu langsam sind,
- notwendige aktivierende Stoffwechselprozesse unvollständig bleiben,
- notwendige aktivierende Stoffwechselprozesse ganz ausfallen oder
- notwendige oder sonstige hemmende (= inhibitorische) Stoffwechselprozesse übermäßig aktiv sind.
- Endogene Stoffwechselsprozessstörungen, die zur pathologischen Verstärkung von Reizverarbeitungsaktivitäten führen
Eine anormale Erhöhung von Reizentstehungs-, Reizweiterleitungs- und Reizübertragungsaktivitäten resultiert aus ähnlichen endogenen Fehlsteuerungen, jedoch unter umgekehrtem Vorzeichen:
- Notwendige hemmende (= inhibitorische) Stoffwechselprozesse in den Neuronen sind zu langsam,
- notwendige inhibitorische Stoffwechselprozesse bleiben unvollständig,
- notwendige inhibitorische Stoffwechselprozesse bleiben ganz aus oder
- notwendige oder sonstige aktivierende (= exzitatorische) Stoffwechselprozesse sind übermäßig intensiv.
Auch hier gilt: Die Kombination verschiedener Prozessstörungen innerhalb einer Zelle ist möglich.
Für innere Vorgänge in Gliazellen gilt Ähnliches, jedoch ist der Zusammenhang von Prozessstörungen in Gliazellen mit Reizverarbeitungsstörungen von Neuronen aufgrund ihrer nur mittelbaren Beteiligung komplexer, zumal es unterschiedliche Formen von Gliazellen gibt, deren Aufgaben erheblich voneinander abweichen. Endogene Stoffwechselstörungen der Gliazellen unterscheiden sich dennoch nicht von denen der Neuronen. Da eine Detaillierung für die weitere Argumentation unerheblich ist und die Darstellung unnötig verkompliziert, wird darauf verzichtet.
Acht Zellprozessstörungen haben nicht nur zwei gegensätzliche Aktivitätsstörungen zur Folge. Sie sind darüber hinaus initial für weitere acht pathologische Zellaktivitäten verantwortlich.
- Erschöpfungseffekt 1: Chronifizierung der Reizverarbeitungsstörungen
Nachdem Nerven- oder Gliazellen eine gewisse Zeit einen unangemessen exzitatorischen oder inhibitorischen Stoffwechsel aufweisen, folgt aufgrund einer energetischen Erschöpfung oder andersgearteter ungünstiger Stoffwechselveränderungen eine langfristig Reduzierung der Reizverarbeitungsaktivitäten.
Da Neuronen im komplexen Zellverband agieren, muss jede Aktivität einer Zelle Auswirkungen auf benachbarte Zellen haben. Aufgrund der Vernetzung übertragen sich die verminderten Aktivitäten eines Neurons auf Nachbarzellen und sorgen für deren Verbreitung.
Hirnstrukturen aus miteinander verschalteten Nervenzellen, wie beispielsweise das aufsteigende retikulär‑aktivierende System (ARAS) der Formatio reticularis, spielen hier eine große Rolle, da sie pathologische Nervenreize diffus weiterleiten und damit breit streuen. Das ARAS verknüpft vor allem Neuronen in Hirnzentren, die für die autonome Verarbeitung von Affekten zuständig sind. Daraus resultieren mehrere Dominoeffekte.
- Dominoeffekt 1: Weiterleitung pathologisch-reduzierter Reize
Eine pathologische Reduzierung der Reizentstehungs-, Reizweiterleitungs- und Reizübertragungsaktivitäten einer Nervenzelle verringert potentiell die Aktivitäten der mit ihr verbundenen Nervenzellen.
Ebenfalls ist der umgekehrte Effekt denkbar, denn aufgrund spezieller Verschaltungen könnten diese reduzierten Reize Aktivitäten in den verbundenen Nervenzellen pathologisch erhöhen.
- Dominoeffekt 2: Weiterleitung pathologisch-erhöhter Reize
Eine pathologische Erhöhung der Reizverarbeitungsaktivitäten erhöht potentiell die Aktivitäten verbundener Nervenzellen. Auch hier ist ein umgekehrter Effekt möglich, so dass atypisch erhöhte Reize die Reizverarbeitung in Nachbarzellen reduzieren.
Stufe 2
Sind die Funktions- bzw. Prozessstörungen schwerwiegend und/oder bestehen sie mittel- bis langfristig weiter, führt das ggf. zu einer pathologischen Verringerung der Zahl von Nervenverbindungen.
Ebenfalls könnte es bei den nachfolgenden Effekten auch zu einer pathologischen Erhöhung der Verbindungen kommen, möglicherweise nur kurzfristig. Eine solche Entwicklung soll jedoch nicht dargestellt werden, da sie alles ohne weiteren Erkenntnisgewinn lediglich verkompliziert.
- Erschöpfungseffekt 2: Direkter Abbau von Neuronenverbindungen
Die Nervenzellen sind nicht mehr in der Lage, ihre zu anderen Zellen geknüpften Verbindungen aufrechtzuerhalten und bauen diese nach und nach ab.
- Erschöpfungseffekt 3: Indirekter Abbau von Neuronenverbindungen durch dysfunktionale Gliazellen
Dysfunktionale Gliazellen belasten die Nervenzellen stark, so dass sie Verbindungen abbauen. Darüber hinaus führt die schlechte Isolierung der Nervenleitungen immer häufiger dazu, dass auch Verbindungen zwischen gesunden Nervenzellen verschwinden oder die Übertragungsqualität der Nervenbahnen so stark sinkt, dass dies einem Verschwinden von Verbindungen gleichkommt.
- Dominoeffekt 3: Abbau von Neuronenverbindungen bei ständiger Unterforderung durch Nachbarzellen
Nervenzellen kappen von sich aus Verbindungen zu den Nachbarzellen, von denen sie keine oder nur noch wenig Impulse bekommen.
- Dominoeffekt 4: Abbau von Neuronenverbindungen bei ständiger Überforderung durch Nachbarzellen
Nervenzellen, die von übermäßig feuernden Nachbarzellen ständig unter „Beschuss“ genommen werden, wenden einen wirksamen Schutzmechanismus an und kappen ihrerseits die Verbindungen.
Stufe 3
Stufe 2 kann in Stufe 3 münden, zum Beispiel weil Prozessstörungen sehr lange bestehen und/oder sehr schwerwiegend sind.
- Erschöpfungseffekt 4: Die Nervenzellen erschöpfen energetisch oder auf andere Weise so stark, dass sie ihre Stoffwechselprozesse nach und nach einstellen. Es kommt in letzter Konsequenz zum Zelltod. Auch Gliazellen sterben ab und reißen ihre Schützlinge, die Nervenzellen, mit. Im besten Falle werden die Zellen vom Immunsystem beseitigt, im schlechtesten Fall bleibt „Zellschrott“ übrig, der zu einer weiteren Belastung für die betroffene Hirnregion wird.
Ein Auffüllen der entstandenen Lücken mit für die Reizverarbeitung ungeeigneten Gliastützzellen ist denkbar. Strukturelle Veränderungen dieser Art sind mit einer MRT so gut wie nicht unterscheidbar. Das kann zu erheblichen Fehleinschätzungen über die Regenerationsfähigkeit einer geschädigten Hirnregion führen.
1.7.2 Zusammenfassung
Die Ergebnisse des Abschnitts 1.7 in der Übersicht.
- Die Aktivitäten von Nervenzellen können grundsätzlich auf zwei verschiedene Arten gestört sein. Entweder liegt eine pathologische Reduktion der Reizverarbeitungsaktivitäten oder eine pathologische Steigerung der Reizverarbeitungsaktivitäten vor.
- Auslöser sind potentiell acht Varianten innerer Prozessstörungen, die Nerven- und Gliazellen betreffen, wobei pathologische Stoffwechselprozesse nicht nur mit der direkten Informationsverarbeitung im Zusammenhang stehen müssen, sondern auch solche Prozesse betreffen können, die für sonstige bzw. allgemeine Zellfunktionen verantwortlich sind, zum Beispiel die Energieversorgung:
- Exzitatorische* Stoffwechselprozesse in Nerven- oder Gliazellen sind zu langsam.
- Inhibitorische** Stoffwechselprozesse in Nerven- oder Gliazellen sind zu langsam.
- Notwendige exzitatorische* Prozesse in Nerven- oder Gliazellen werden unvollständig durchgeführt.
- Notwendige inhibitorische** Prozesse in Nerven- oder Gliazellen werden unvollständig durchgeführt.
- Notwendige exzitatorische* Prozesse in Nerven- oder Gliazellen fallen vollständig aus.
- Notwendige inhibitorische** Prozesse in Nerven- oder Gliazellen fallen vollständig aus.
- Notwendige oder sonstige exzitatorische* Prozesse in Nerven- oder Gliazellen sind übermäßig intensiv.
- Notwendige oder sonstige inhibitorische** Prozesse in Nerven- oder Gliazellen sind übermäßig intensiv
* Exzitatorisch = aktivierend
** Inhibitorisch = hemmend
Diese acht Prozessstörungen führen nicht nur zu unmittelbaren Reizverarbeitungsstörungen, sie haben mittel- bis langfristig auch eine initiale Wirkung und potentiell weitere acht Erschöpfungs‑ und Dominoeffekte zur Folge. Diese Effekte betreffen die durch Neuronenvernetzung und Neuronenzahl charakterisierte Hirnstruktur.
In Summe führen Zellprozessstörungen potentiell zu 10 Formen pathologischer Reizverarbeitung:
- Pathologische Reduktion der Reizverarbeitung.
- Pathologische Steigerung der Reizverarbeitung.
- Erschöpfungseffekt 1 (Chronifizierung der Reizverarbeitungsstörungen):
Eine übermäßige Stoffwechselerhöhung mündet aufgrund von energetischer Erschöpfung oder andersartiger Veränderungen in eine chronische bzw. langfristige pathologische Stoffwechselverminderung mit der Folge chronisch verminderter Reizverarbeitungsaktivitäten.
- Erschöpfungseffekt 2 (Direkter Abbau von Neuronenverbindungen):
Chronisch erschöpfte Nervenzellen sind nicht mehr in der Lage, ihre zu anderen Zellen geknüpften Verbindungen zu halten und bauen diese nach und nach ab.
- Erschöpfungseffekt 3 (Indirekter Abbau von Neuronenverbindungen durch Gliazellen):
Chronisch dysfunktionale Gliazellen belasten die Nervenzellen und tragen dazu bei, dass Verbindungen zwischen Nervenzellen direkt abgebaut werden oder dass dies aufgrund der dadurch verursachten schlechten Übertragungsqualität einem Verschwinden entspricht. Letzteres ist ebenfalls zwischen gesunden, unbelasteten Nervenzellen möglich.
- Erschöpfungseffekt 4 (Zelltod):
Eintritt der Hirnzellen-Apoptose durch eine maximale Erschöpfung als letztmögliche Reaktion auf eine anhaltende und/oder extreme Überforderung des Stoffwechsels.
- Dominoeffekt 1 (Weiterleitung pathologisch-reduzierter Reize):
Die pathologische Verringerung der Reizverarbeitungsaktivitäten einer Nervenzelle wird auf benachbarte bzw. verbundene Nervenzellen übertragen, die daraufhin ebenfalls ihre Aktivitäten dämpfen.
- Dominoeffekt 2 (Weiterleitung pathologisch-erhöhter Reize):
Die pathologische Erhöhung der Reizverarbeitungsaktivitäten einer Nervenzelle erhöht in gleicher Weise die der benachbarten bzw. verbundenen Nervenzellen.
- Dominoeffekt 3 (Pathologischer Abbau/Aufbau von Neuronenverbindungen bei ständiger Unterforderung):
Nervenzellen kappen oder erweitern von sich aus Verbindungen zu verbundenen Nervenzellen, von denen sie keine oder nur noch wenig Impulse bekommen.
- Dominoeffekt 4 (Pathologischer Abbau/Aufbau von Neuronenverbindungen bei ständiger Überforderung):
Nervenzellen, die von übermäßig feuernden Nachbarzellen ständig unter „Beschuss“ genommen werden, kappen oder erweitern die Verbindungen aktiv.
Mit der Beschreibung acht endogener Prozessszenarien ist noch keine einzige dafür verantwortliche Ursache benannt.
Den Ursachen kann man nur mit Hilfe eines geeigneten Zellmodells auf die Spur kommen, das gezielt auf physiologische Schwachstellen untersucht wird. Im folgenden Kapitel 2 wird ein solches Zellmodell entworfen.
Zum nächsten Kapitel 2 (Zellprozessmodell) bitte hier klicken: ►